ヘルスケアコンプライアンスへのポケットガイド
公開: 2020-06-26ヘルスケアは、インフラストラクチャの景観とサービスを近代化するためにデジタルテクノロジーが攻撃されている主要なセクターの1つです。
医療機関の支出を基準として、ヘルスケアは他のセクターとの対応において米国政府の支出を大幅に上回っています。 2017年、米国は3.5兆ドルを医療に割り当てました。 国のGDPのシェアとして、これは17.7パーセントに達しました。 米国のヘルスケアは、投資と拡大のために大量の資本を抱えるレガシービジネスに限定された領域ではありませんが、すべての人が参加できます。
デジタルヘルスは、遠隔医療、スマートフォンアプリによるリモート監視、処方薬の玄関先配達などのビジネスモデルを含む、この業界の発展途上の展望です。 2019年だけでも、米国内の1,700以上の取引でデジタルヘルスケアの採用を提唱する新興企業によって、 170億ドル以上が調達されました。 この進行中の変化から予想されるように、モバイルヘルスケアの開発が中心的な段階にあります。
個人の衛生状態に影響を与える/改善すると主張する製品を開発することは、関連するヘルスケアソフトウェア開発サービスの課題のためではなく、受託者ガイドラインのために、クラックするのが難しいです。
Appinventivは、この変化の最先端にあり、パートナーのおかげで業界の鼓動を鼓舞しています。 ヘルスケアアプリ開発会社として、私たちはそこにいて、それを実行しました。これは、画期的なアイデアを実現するために必要でした。 自信を持って、本日は、mHealthアプリケーションを開発する際に留意しなければならない一般的な規制とコンプライアンスについて説明します。
医療規制コンプライアンスとは何ですか?
ヘルスケアにおける規制順守とは、医師会がそのビジネスプロセスに適用される法律、ガイドライン、規制、および仕様を順守することです。 規制順守の違反は、連邦罰金を含む法的な罰を定期的にもたらします。 これは、特定の医療機関またはサプライヤーに関連する合法、道徳的、および専門的な規範を満たす、または超えるという継続的なサイクルです。
現在、病院や医療提供者などの医療会社には、規制順守に特に重点を置いた専任のチームメンバーがいます。 病院の規制要件の理由と本質的な利点は、患者のケアを改善することです。
ヘルスケアにおけるコンプライアンスの目的は何ですか?
医療コンプライアンスは、各医療提供者の基本的なセグメントです。 これは、医療サービスの実践に関連する規則、ガイドライン、法律、および規制に従う方法です。
ヘルスケアにおけるコンプライアンスは、さまざまな慣行をカバーし、内部および外部のルールを順守します。 ただし、ほとんどの医療サービスコンプライアンスの問題は、患者のセキュリティ、患者データの保護、および請求のリハーサルと一致します。
米国保健社会福祉長官(HHS)は、医療保険の相互運用性と説明責任に関する法律(HIPAA)として知られる国全体の基準を作成しました。医療コンプライアンスの中心的な機能は、この法律を支持することです。
ヘルスケアコンプライアンスが重要なのはなぜですか?
コンプライアンスにより、タスクがスムーズに実行され、全員が合法的な手順に従い、前提条件を理解できるようになります。
それでも、医療サービスのコンプライアンスは、さまざまな業界よりも大幅に高い利害関係を伴います。 一方、医師や看護師などの開業医が合法的な手順に従わない場合、患者や他のスタッフに危害を加える可能性があります。
究極的には、医療コンプライアンスとは、安全で質の高い患者ケアを提供することです。 業界標準および規制に準拠することで、医療機関は引き続きケアの質を向上させることができます。
最後に、医療コンプライアンスとは、保護された、質の高い、安全な、患者のケアを提供することです。 業界のガイドラインと規制に準拠することで、医療機関はケアの質を向上させ続けることができます。
医療機関は、政府からの厳格なガイドライン、法律、規制に拘束されています。 これらの法律に違反すると、訴訟、多額の罰金、さらには免許の喪失をもたらす可能性があります。
コンプライアンス問題のリスクが高いものは何ですか?
規制の枠組みは、制裁ガイドラインに利用されるモデルとして機能します。 このような構造は、ヘルスケア業界などの明確な関心領域内に作成される可能性があります。 政府は、ガイドライン、規則、および法律を作成および制定するために、そのようなフレームワークの利用に依存することがよくあります。 規制の枠組みは通常、最終目標を念頭に置いて最初に開発されます。
みんなを悩ませている主な質問を調べてみましょう。それは、ヘルスケアにおけるコンプライアンスの問題とは何ですか?
HIPAAとデータ侵害
価値に基づく報酬の取り決め
反キックバックと医師-病院の問題
デューデリジェンスプロセス
遠隔医療プロバイダーの資格
回復監査請負業者
免税病院とコンプライアンス要件
米国における医療規制とコンプライアンス
デジタルヘルスには、ヘルスインフォメーションテクノロジー(HIT)、モバイルヘルス、パーソナライズされた処方箋、ウェアラブルテクノロジー、テレヘルスの推奨事項と禁止事項を指摘する詳細な制限があります。 モバイルアプリは、オフラインオンラインサービスまたはサービスとしてのソフトウェアを介した医療提供の最も一般的な方法の1つです。 その場合、起業家は次の質問をチョークで書き、それらに対する客観的な答えを見つける必要があります。

上記のアンケートは、モバイルアプリに受託者の承認が必要かどうかを示しています。 あなたの答えがほとんどイエスだったとすると、あなたのmHealth製品の問題を調査する3つの連邦機関があります:
- 食品医薬品局(FDA)
- 連邦取引委員会(FTC)
- 公民権局(OCR)
以下では、連邦政府の主要な機能分野と、ヘルスケアソフトウェア開発会社がクライアントにアドバイスしなければならない詳細なファクトチェックの範囲について説明します。
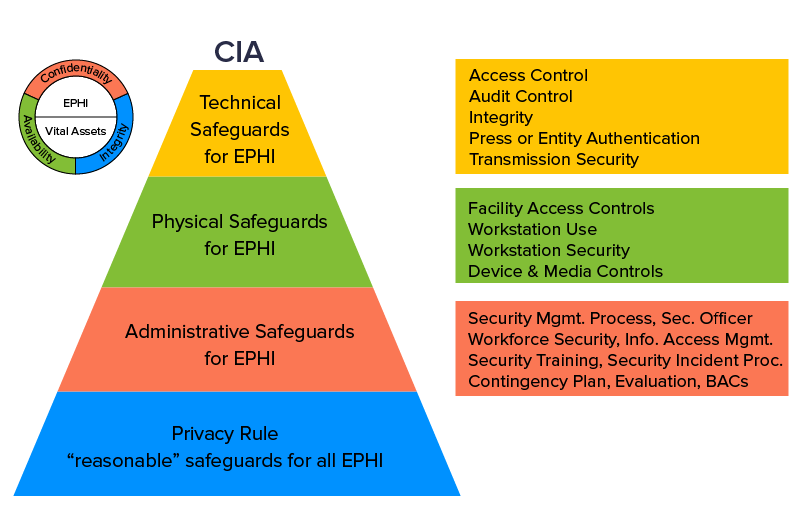
1.医療保険の相互運用性と説明責任に関する法律(HIPAA)
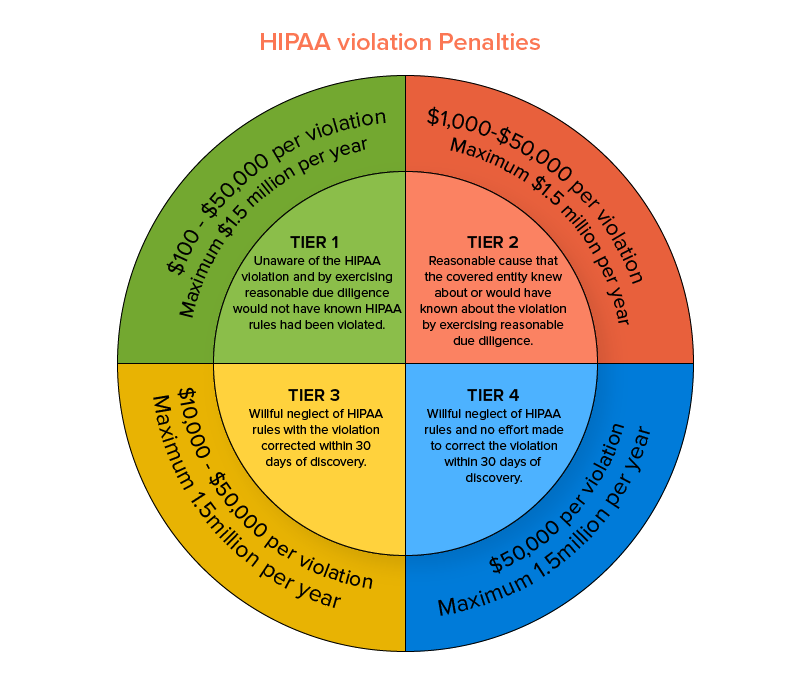
この法律は、米国保健社会福祉省内の市民権局(OCR)によって施行されています。 この医療に準拠したHIPAAセキュリティルールは、適格な健康関連データのプライバシーとセキュリティの懸念を保護し、特定の場合には、データ侵害の報告が必須であると見なします。 特定のHIPAAセキュリティルールに従わないと、最低100ドルの支払いから始まり、インシデントごとの違反ベースで150万ドルまでのペナルティが発生する可能性があります。
医療規制要件に取り組む際の深刻さについての明白なアイデアが得られたので、次に進んで、HIPAAの従来のポリシーに準拠する必要がある医療アプリの種類を調査する必要があります。 3つの3つの要素が、運用面で医療として区別されるアプリの適格性基準を決定します。
I.アプリケーションを使用するエンティティの性質。
エンティティとは、アプリを使用する顧客を指します。 医師、医師、病院などの組織、健康保険会社など、HIPAAの憲法の対象となる事前定義された開業医のセットがあります。 彼らがアプリの直接の受益者である場合、 HIPAAによる医療規制と病院規制コンプライアンスのリストを一言一句従う必要があります。 一方、アプリが単に衛生のヒントや健康に関する知識をキュレートして顧客と共有する場合は、HIPAAの憲法から免除されます。
II。 アプリケーションが生成、保存、共有するデータの性質。
データは、オンラインビジネスの機能するニーズにとって重要です。 連邦当局は、データ侵害などのセキュリティ上の懸念を否定し、堅牢な暗号化インフラストラクチャの存在を保証する法律を推進しています。 本質的に、収集されたデータは、住所、社会保障番号などの個人情報を介して悪意のある攻撃者を人々に導くべきではなく、またそうしてはなりません。アプリがそのような個人的なピンポイントの使用を処理する場合、HIPAAルール適用されます。

III。 アプリケーションを強化する基盤となるソフトウェア。
最高のヘルスケアモバイルアプリの開発は、安全な電話アプリの革新に集中する必要があります。 HIPAAは、保護された医療情報(PHI)の詳細を共有し、ソフトウェアベンダーにその周りのセーフティネットを粉砕するように指示します。 その指令には、PHIにインストールされる監査と内部統制の詳細なチェックリストがあります。
2.連邦取引委員会法(FTC法)
この法律は、プライバシーの問題や一般的なデータセキュリティの課題に関連する、企業における不当な主張や不正行為に対処するための規制プロトコルを課しています。 アプリの使用に関する根拠のない主張は、この法律の対象となります。 FTCの健康侵害通知規則は、個人の健康記録などのデータ侵害を報告することを特定の企業に義務付けています。
3.連邦食品医薬品化粧品法(FD&C法)
食品医薬品局は、この法律の実施を委託されています。 彼らの主な目的は、医療機器(モバイルアプリケーションを含む)が標準ガイドラインに適合し、したがって大量に安全に消費できるようにすることです。 すべてのヘルスケアアプリがこの管轄下にあるわけではなく、一部のアプリがこの管轄下にあることを私たちが言及することが最も重要です。 これらは、クレームを提供できない場合、消費者の健康に深刻な結果をもたらすものです。
追加規制 デジタルヘルスの場合
上記の行為は鋭く標的にされたヘルスケアアプリケーションでしたが、理由のために制定されなかったが、同じものを含むように調整された他のものがあります。 このセクションでは、mHealthの起業家が遵守しなければならない、州が支援する規範の概要を評価します。
1.食品医薬品局(FDA)
食品医薬品局は、米国政府が支援する機関であり、米国保健社会福祉省の主要な構成要素を構成しています。 ヘルスケアアプリの開発者は、FDAの認可を取得するためにアプリを設計する際に、このような明確に定義された一連のガイドラインに注意する必要があります。 デジタルヘルスセクターの場合、FDAは、次の2つの仮定に基づいて、モバイルアプリを「医療」スラブに分類します。

- このアプリは、すでに規制されている医療機器と一緒に、または一緒にアクセサリとして利用されます。
- アプリは、モバイルプラットフォームを規制されたモバイルデバイスに変形します
前述の第1レベルの分類に基づいて、アプリのサブセクターは、FDAの承認に近づくために、次の新しいデジタルテクノロジーとの関係に基づいて定義されます。
I.医療機器としてのソフトウェア(SaMD)
SaMDは、ソフトウェアがハードウェア医療機器/デバイスに関連付けられることなく医療目的で使用されるモデルとして定義されます。 このモデルは柔軟性が高く、仮想ネットワークから医療機器まで、さまざまなプラットフォームに適用できます。
国際医療機器規制当局フォーラム(IMDRF)は、医療機器の体系的なガバナンスを提唱する世界的な連合です。 2013年には、このセグメントでのデジタルテクノロジーの進歩をサポートするための実用的なガイダンスを導入するために、ソフトウェアを医療機器ワーキンググループ(SaMDWG)として策定しました。 FDA自体が率いるこのグループは、以下に関する多数のフレームワークを文書化しています。
- 定義
- リスクの分類
- 品質管理システム
- 臨床評価
それらのカタログを調べると、SaMD承認を取得するかどうかを特定するのに役立ちます。
II。 ワイヤレス医療機器
これは、医療サービスを容易にするために情報スラッシュデータのワイヤレス送信を実行する機能を備えた医療機器を指します。 このようなツールキットは、WiFi、Bluetooth、またはスマートフォンを介して送信できる通信用の無線周波数を展開します。 一般的な例として、企業のオフィスで見られる可能性のあるものは、RFID(Radio Frequency Identification)デバイスです。

III。 遠隔医療
Health ITは、FDAの承認を取得するプロセスを簡素化するために、遠隔医療と遠隔医療に分かれています。 テレヘルスは、ヘルスケア関連の機能を促進およびサポートするための電気通信の使用として指定されています。これは、COVID-19の発生以来ますます脚光を浴びているものです。 カスタムヘルスケアソフトウェア開発会社は、以下を使用するアプリケーションを開発できます。
- ライブ(非同期)ビデオ会議
- ストアアンドフォワード(非同期)ビデオ会議
- リモート患者モニタリング(RPM)
- モバイルヘルス(mHealth)
IV。 医療IT
この場合、健康情報技術国家コーディネーターの連邦政府機関によって提供された定義を引用する方がよいでしょう。「ハードウェア、ソフトウェア、統合技術または関連ライセンス、知的財産、アップグレード、またはサービスとして販売されるパッケージソリューション健康情報の電子的な作成、保守、アクセス、または交換のために、医療機関または患者による使用をサポートするように設計されています。」
V.医療機器データシステム(MDDS)
データのチャネル化、情報の保存/保存、データのある形式から別の形式への変換、または単に科学/医療データの表示に使用できるハードウェア/ソフトウェア製品は、MDDSカテゴリに分類されます。 このようなデバイスの目的は、追加の特性を提供したり、データセットを強化したりすることではなく、単にそれを表示することです。
VI。 医療機器の相互運用性(MDI)
安全な電話アプリの概念がMDIよりも完全に優れているデジタルヘルスサブドメインは他にありません。 医療機器の相互運用性とは、複数の機器間でのクロスプラットフォーム/技術的な情報交換を指します。 主な動機がプレゼンテーションであるMDDSとは異なり、MDIアプリケーションはデータを表示、保存、および分析できます。 往復通信の結果として、それらは他の製品を制御するためにも使用できます。
VII。 デバイスソフトウェア機能
このカテゴリについて話すとき、認可はFDAガイドラインの下で「デバイス」として認定されたソフトウェアアプリにのみ与えられます。 消費のリスクが最小限またはまったくないソフトウェアデバイスは、FDAの正式な承認を必要としない場合があり、そのような場合、組織はそれを明示します。
「執行の裁量を行使し、製造業者が市販前レビュー申請書を提出したり、FDAにソフトウェアを登録してリストしたりすることを期待しません。 」
VIII。 サイバーセキュリティ
サイバーセキュリティ自体は、mHealthアプリの分類モードではありません。 それでも、FDAは、明確な了解覚書(MOU)を確立して、アプリがユーザーにもたらすメリットとデータセキュリティの課題を比較検討できるようにしたいと考えています。
IX。 人工知能/機械学習
AIがヘルスケアに与える影響は、他のテクノロジーに対して不釣り合いに大きいものです。 しかし、このセクターの進歩はかなり最近のものであり、そのためFDAは規制の枠組みを調整しなければなりませんでした。 最新のガイドラインに従って、FDAはメーカーと協力して、市場前の開発段階から市場後のパフォーマンス段階に至るまで、ソフトウェアを継続的に評価します。 このフレームワークは、特にSaMDに適用されます。
2.HL7標準
Health Level Seven Internationalは、単にHL7と呼ばれ、1983年に設立された非営利団体であり、手続き型医療行為を可能にする電子健康情報の交換、統合、共有、および取得のための業界ベンチマークを開発しています。 それに加えて、 HL7標準は、医療サービスの管理において基本的な役割を果たし、シームレスな医療提供と結果の評価に向けて順調に進んでいます。
彼らはどのようにそれをしますか?
HL7標準は、2つのヘルスケアアプリ間で相互運用可能な情報のパッケージ化を定義し、システムに簡単に統合できるように、言語、データ形式、およびその構造のワークフローを規定しています。 そうすることで、彼らは技術インフラへの投資を減らし、患者に利益をもたらし、医療をより手頃な価格にします。 ドラフトされた規則に準拠してHL7の承認を取得することは、医療業界を規制するための2つの利点をもたらします。 まず、ヘルスケアアプリは広く受け入れられており、世界中に展開する準備ができています。 そして第二に、アプリケーション開発のコストが削減されます。
3.ハイテック法
経済的および臨床的健康のための医療情報技術法は、2009年のバラクオバマ大統領の政権の間に導入されました。HITECH法の目的は、電子健康記録(EHR)を通じて医療情報技術の企業での採用を促進することでした。 政権はまた、1996年のHIPAA法をめぐる緩い終わりを厳しくし、その後、医療事業者は、顧客の資格が侵害されたかどうか、いつ侵害されたかを顧客に通知することが義務付けられました。
HITECH法の直接の効果は、EHRのおかげで、2つの異なるエンティティ間の情報共有がより簡単に処理できるようになったということでした。 この法律はまた、侵害が困難なセキュリティインフラストラクチャが、HIPAA法のプライバシーとセキュリティの必須事項と連携してインストールされることを保証しました。 HITECHの承認を取得するためのすべての規制要件は、最終オムニバス規則を介してHIPAAに組み込まれ、その結果、両方の行為が単一の法律の下で積み重ねられました。
4.BYOD
BYOD(Bring Your Own Device)は、医療従事者が医療スタッフにスマートフォンやタブレットなどの個人用デバイスを公務に使用することを許可する概念的な手法です。 mHealthソリューションがBYODセキュリティプロトコル用にカスタマイズされていない場合、事態は一瞬で悪化する可能性があります。 たとえば、従業員が重要なProtected Health Information(PHI)にアクセスできるデバイスを持ってスマートフォンを紛失した場合を想像してみてください。
ここで、強く考え抜かれたモバイルデバイス管理戦略が役立ちます。 アプリ開発者がmHealthソリューションにリモートワイプ機能を組み込んでいれば、紛失したデバイスに関連するデータを消去できます。 BYODアンブレラ内の同様の機能には、電子メールやブラウザなどのクライアントアプリケーションの保護が含まれます。 SDLCの初期段階でこのような細かな点に注意することは、スタートアップが最終的にBYOD承認を取得するのに役立つ可能性があります。
5. GDPR
一般データ保護規則は、欧州連合(EU)によって作成され、欧州連合市民の顧客データを収集および処理するスマートフォンアプリケーションに適用されます。 EUの国境を越えた作業でのこの行為の同様の反復の話で、アプリ開発者が同じようにmHealthソリューションを作成することは安全対策と見なされます。 プライバシー保護はGDPRの本質であり、連邦当局は個人データの管理を素人に引き継ぐことを(成功して)試みました。 また、プライベートデータ管理に関連するビジネス慣行を公開しません。

GDPRの規定では、モバイルアプリは、データを収集または処理する前に、許可、つまりアクティブなユーザーの同意を要求する必要があります。 アプリは、ユーザーがチェックボックスまたはその他のボタンをクリックしてアクションを登録することで、ユーザーが簡単に合意を共有できるようにする必要があります。 さらに、そのようなチェックボックスは、妨げられないようにしなければならないユーザーの選択に心理的に影響を与えるように、事前にチェックされるべきではありません。 利用規約ページには、独自の[同意する]ボタンが必要です。 GDPRは、ユーザーが同意した後でも、ユーザーが選択した場合、アプリに付与されたすべての権利を取り消して解放できるため、個人データの管理を大幅に民主化しました。 モバイルアプリ開発会社のエンジニアがこの議論を考慮したソリューションを提供していれば、当局からのGDPR承認の有効化は比較的簡単です。
最終的な考え
mHealth、遠隔医療、センサー、ウェアラブル技術、リモート監視ツールなどのデジタルテクノロジーのおかげで、全国の医療費は2026年までに5.7兆ドルに達すると予想されています。 このようなヘルスケアの傾向は、一般の人々に即座にアウトリーチするためのテクノロジーを組み込んだ、これまでに見たことのない医療ソリューションの困難な行進を示しています。 彼らはまた、利用できるサービスではなく、持つべき基本的権利として、すべての人にとって医療を手頃な価格にすることが期待されています。 ベンチャーのビジネス面に焦点を当てている間、米国でトップのヘルスケアアプリ開発エージェンシーの1つであるAppinventivを技術ガイドとして待機させてください。
ご意見をお待ちしております。
