医療機器としてのソフトウェア:規制の定義と範囲
公開: 2019-09-06過去40年以来、医療機器内外の技術革新の数は劇的に増加しています。 特に、過去20年間は、モノのインターネットと、ワイヤレス接続、クラウドコンピューティング、AIなどの他の対応する部分の台頭のおかげで、このセクターの加速を目の当たりにしてきました。これらの進歩は、医療プロセスを変革しました。
20年経った今でも、これらの最先端テクノロジーは、ヘルスケアの管理と提供のプロセスに大きな変化をもたらし続けています。
そして今、モバイルアプリケーションも浸透し、これらの非常に要求の厳しい、テクノロジーベースの医療および非医療目的の重要な部分になっています。
それ自体が医療機器であるこれらのアプリまたはソフトウェア–医療機器の市場規模としてのソフトウェアは、ユーザーの生活の本質的な部分に成長しました。 SaMDのアプリケーションは、診断だけでなく、監視および治療プロセスでも使用されています。 実際、ヘルスケア1.0からヘルスケア3.0への進化をもたらしたのはSaMDです。
日常の医療にSaMDがますます含まれるようになると、米国FDAが加盟している国際医療機器規制当局フォーラム(IMDRF)は、医療アプリ開発業界が従うべき概念とSaMDリスクカテゴリについて詳細に説明しました。 医療機器としてのFDAソフトウェアは、要件の伝達を改善するためのリスクベースのポリシーを開発および明確化し、その規制アプローチをデジタルデバイスの進化する性質と整合させました。
* SaMDは、ヘルスケア業界の利害関係者–mHealthアプリケーションの起業家やデバイスメーカーが従うべき唯一のコンプライアンスではありません。 FDA、HIPAA、HL7、FCPAなどの他のコンプライアンスもあります。 これらのコンプライアンスについては、 mHealthcareアプリ開発ガイドこの記事では、 SaMD、医療機器規制としてのソフトウェア、および医療機器としてのソフトウェアとして分類されるmHealthアプリの種類やその他の種類の医療ソフトウェアについて説明します。
目次
- 医療機器としてのソフトウェアとは何ですか?
- モバイルアプリがSaMDであるかどうかを知る方法は?
- SaMDの特性評価で考慮すべき要素
- 医療機器としてのソフトウェアの例は何ですか?
- ソフトウェアを医療機器としてどのように分類しますか?
- SaMDメーカーは規制を確実にするために何ができますか?
- 結論
- SaMDに関するFAQ
医療機器としてのソフトウェアとは何ですか?

用語–医療機器としてのソフトウェアは、1つまたは複数の医療目的での使用を目的とし、ハードウェア医療機器に統合されることなくこれらの目的を実行するソフトウェアを表します。
IMDRAFがSaMDを定義する方法は次のとおりです–
「「医療機器としてのソフトウェア」(SaMD)という用語は、ハードウェア医療機器の一部でなくても、これらの目的を実行する1つ以上の医療目的で使用することを目的としたソフトウェアとして定義されます。」
モバイルアプリがSaMDであるかどうかを知る方法は?
- SaMDは医療機器であり、いくつかの体外診断(IVD)医療機器が含まれています。
- 汎用(非医療)コンピューティングプラットフォームで実行できます。
- ソフトウェアは、その意図された目的がハードウェア医療機器を駆動することである場合、SaMDの定義を満たしていません。
- 医療機器など他の製品と併用できる場合があります。
- これは、ハードウェア医療機器や他のSaMDソフトウェア、および汎用ソフトウェアを含む他の医療機器とインターフェースすることができます。
SaMDの特性評価で考慮すべき要素
SaMDを特徴付ける方法は2つあります。
SaMDが提供する情報
- 患者を診断または治療するため
- 臨床管理に通知する
- 臨床管理を推進する
ヘルスケアの状態
- 危険な状態
- 重篤状態
- 深刻ではない状態
これらの特性に基づいて、SaMDは4つのカテゴリに分類されます。
医療機器としてのソフトウェアの例は何ですか?
- 医療機器としてのソフトウェアは、ハードウェア医療機器を含む他の医療機器、および臨床機器として、また汎用ソフトウェアとしての他のソフトウェアとインターフェースすることができます。 境界を与えるソフトウェアは、別のハードウェア機器または他のSaMDの入力になります。 たとえば、医療機器の例としてのソフトウェアは、線形加速器で利用されるデータをプロビジョニングする治療計画ソフトウェアであるSaMDである可能性があります。
- たとえば、民生用デジタルカメラに搭載されたプロセッサで動作する3軸加速度計を利用して状態の分析が期待されるソフトウェアは、医療機器としてのソフトウェアと見なされます。
- 医療用ハードウェアデバイスに接続されているが、そのデバイスがその医療目的を達成するために必要としないソフトウェアは、医療用デバイスとしてのソフトウェアであり、医療用デバイスのアクセサリではありません。
- SMDソフトウェアは、汎用(つまり非臨床的な理由)のコンピューティングプラットフォームで実行できます。 これらの汎用コンピューティングプラットフォームで実行されるこれらのソフトウェアは、ハードウェア医療機器に配置できます。
SaMDのカテゴリワイズの例
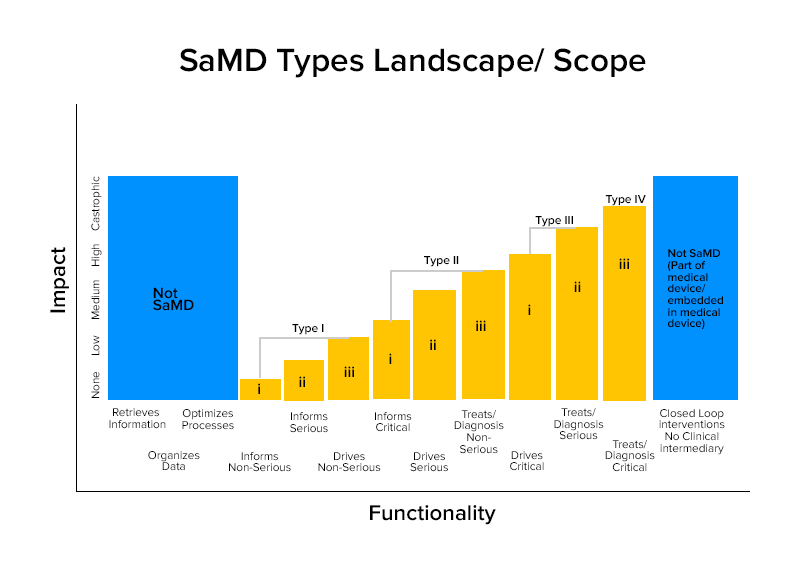
カテゴリIV:
- 患者が急性脳卒中を患っているときに治療の決定を可能にするための診断画像分析を実行するSaMD
- 病変のフラクタル次元を計算し、病変が良性または悪性であるかどうかの診断または識別を提供するためのさまざまな成長パターンを明らかにする構造マップを構築するSaMD。
- SaMDは、イムノアッセイからのデータを組み合わせて、高度に伝達可能な変異性病原体の発生をスクリーニングします。
カテゴリーIII:

- 睡眠中の呼吸の中断を検出するために電話のマイクを利用するSaMD 。
- これは、写真をクリックして情報を提供したり、成長やその他のデータを監視したりして、医療提供者が皮膚病変が良性か悪性かを診断するために使用するその他の情報を補足するために使用されます。
カテゴリーII:
- 心拍数を分析するSaMD。
- 心臓病や脳卒中のリスクを予測し、予防戦略を作成するために個人の健康記録データを使用するSaMD。
- 複数のテストを統合および分析して、特定の臨床適応症における診断の推奨事項を提供するSaMD。
カテゴリーI:
- 喘息エピソードの発生を測定するための情報を提供するために症状日記からデータを収集するソフトウェア医療機器。
- 画像を分析するソフトウェア医療機器、乱視の次の診断アクションを導くための目の動き。
- 医療提供者が確認できるように、過去の血圧情報を保存するソフトウェア。
- 聴覚過敏、騒音下でのスピーチのデータを使用し、難聴の自己評価のための一般的なリスニング状況に関する質問票への回答をユーザーに求めるソフトウェア。
ソフトウェアを医療機器としてどのように分類しますか?
新しいEUMDR(欧州連合医療機器規制)は、医療機器ソフトウェア規格の定義、規則、分類、および手続き上の必要性を提供します。
EU MDR Annex VIIIは、医療機器分類ルールとしてのさまざまなソフトウェアについて説明しています。
附属書VIIIの規則11は、ソフトウェアの分類に関連しており、特に、単独で、または医療機器と組み合わせて使用されるソフトウェアの分類に対応しています。
診断または治療目的の選択を行うために利用されるデータを提供するために計画されたソフトウェアは、そのような選択が個人の健康の死または不可逆的な悪化を引き起こす可能性がある場合を除いて、クラスIIaに分類されます。 そのような場合、それはクラスIIIにあるか、個人の健康状態の深刻な悪化または外科的介入であり、その場合、それはクラスIIbに分類されます。
生理学的プロセスをスクリーニングすることが期待されるソフトウェアは、必須の生理学的パラメータを観察するために提案された場合を除いて、クラスIIaとして委任されます。ただし、これらのパラメータの種類の性質は、患者に即時の脅威をもたらす可能性があります。クラスIIbという名前。 他のすべての残りのソフトウェアは、クラスIとして委任されます。
たとえば、定期検査中に心拍数やその他の生理学的パラメータをスクリーニングするために使用されるソフトウェアは、クラスIIaとして委任されます。 万が一、モニタリングが必須の生理学的パラメータに焦点を合わせており、それらのパラメータが患者に即時の危険をもたらす可能性がある場合、分類はクラスIIbに引き上げられます。
SaMDメーカーは規制を確実にするために何ができますか?
SaMD企業は、規制へのコンプライアンスを確保するために、開発プロセスに優れた品質管理システムを組み込む必要があります。 選択したQMSプラットフォームは、FDA 21 CFR Part820やISO13485:2016などの規制要件に準拠できる必要があります。
方向に誤りがあると、アプリケーションが禁止されて転換点にすぎないという深刻な結果につながる可能性があります。 重要性に注意して、これらの規制とコンプライアンスを完全に理解している開業医と協力するカスタムヘルスケアソフトウェア開発会社と提携することをお勧めします。
結論
現在、医療機器に関連して、またはスタンドアロンの医療機器として使用されるソフトウェアを開発している米国のヘルスケアアプリ開発会社は、これらの変更を認識し、ソフトウェアが新しい体制に準拠していることを確認するための対策を確実に実装する必要があります。

SaMDに関するFAQ
Q. SaMDではないソフトウェアの例は何ですか?
- ハードウェア医療機器がその役割を果たすために必要なアプリ。
- 医療機器データに依存するアプリ。
- 訪問のスケジュール設定、ビデオ通話や音声通話など、臨床ワークフローのコミュニケーションと合理化を可能にするアプリ
アプリの例はこれらに限定されません。 SaMDの定義に該当しないアプリの種類は他にもたくさんあります。
Q.医療機器としてのソフトウェアは実際に何ができるのですか?
SaMDアプリケーションは、診断を行ったり、X線処理を行ったり、インスリン投与量を計算したりすることで、ユーザーに身体の健康に関する洞察を提供するスタンドアロンの健康アプリケーションとして機能するアプリケーションです。
Q. IEC 62304とは何ですか?
IEC 62304は、医療機器としてのソフトウェアおよび医療機器内のソフトウェアの作成に必要なライフサイクル要件を指定する規格です。 ISO 13485と併用すると、医療機器ソフトウェアの安全な設計と保守に重要なフレームワークが提供されます。
Q.医療機器ソフトウェア開発のQMSプロセスについて説明してください
私たちは、医療機器や製薬会社と協力して独自の品質を確保するための独自の内部QMSを持っています。 クライアント、サードパーティ、または規制当局による監査は受けません。
ステージ1 :プロジェクトの開始:クライアントとのキックオフ電話会議を実施して、次のことを行います。
プロジェクト計画とタイムラインを確認する
主要な情報源を完成させる
プロジェクトチームを定義する
ステージ2 :ドキュメントのレビュー:既存の製品情報、非臨床データ/計画、および規制ドキュメントを含むすべての関連ドキュメントを評価および調査します。 この情報のソースは次のとおりです。
非臨床データ、規制対応、製品技術仕様、述語デバイスへの参照、提案された製品クレーム、および使用目的/適応症など。
ステージ3 :規制経路の決定上記のセクションの情報を使用して、510(k)またはde novoが最も適切かどうかを決定するFDA規制経路を作成します(PMA規制戦略はより複雑で、より高い予算が必要になります)。 目標は、FDAへの最適なアプローチについてクライアントにアドバイスすることです。
