Logiciel en tant que dispositif médical : définition et portée de la réglementation
Publié: 2019-09-06Depuis les 40 dernières années, le nombre d'innovations technologiques à la fois dans et autour des dispositifs médicaux a considérablement augmenté. Surtout, les 20 dernières années ont vu une accélération du secteur, grâce à l'Internet des objets et à la montée en puissance de ses autres composants correspondants comme la connectivité sans fil, le cloud computing, l'IA, etc. Ces avancées ont transformé les processus de soins de santé.
Même après 20 ans, ces technologies de pointe continuent de provoquer un changement sismique dans le processus d'administration et de prestation des soins de santé.
Et maintenant, les applications mobiles se sont également infiltrées et sont devenues une partie importante de ces objectifs médicaux et non médicaux très demandés et basés sur la technologie.
Ces applications ou logiciels qui sont un dispositif médical à part entière - La taille du marché des logiciels en tant que dispositifs médicaux est devenue une partie intégrante de la vie des utilisateurs. Les applications du SaMD ne se limitent pas seulement au diagnostic mais ont également fait leur place dans le processus de suivi et de traitement. En fait, c'est SaMD qui a conduit à l' évolution des soins de santé 1.0 vers les soins de santé 3.0 .
Constatant l'inclusion croissante de SaMD dans les soins de santé de tous les jours, le forum international des régulateurs des dispositifs médicaux (IMDRF), dont la FDA américaine est membre, a décrit en détail le concept et les catégories de risque SaMD à suivre par l'industrie du développement d'applications médicales. Le logiciel de la FDA en tant que dispositif médical a développé et clarifié des politiques basées sur les risques pour une meilleure communication des exigences et a aligné son approche réglementaire sur la nature évolutive des dispositifs numériques.
* SaMD n'est pas la seule conformité que les acteurs de l'industrie de la santé - les entrepreneurs d'applications mHealth et les fabricants d'appareils devraient suivre. Il existe également d'autres conformités, telles que FDA, HIPAA, HL7 et FCPA. Nous avons abordé ces conformités en détail dans notre Dans cet article, nous allons jeter un peu de lumière sur SaMD, la réglementation des logiciels en tant que dispositifs médicaux, et les types d'applications mHealth et d'autres types de logiciels médicaux qui sont classés comme logiciels en tant que dispositifs médicaux.
Table des matières
- Qu'est-ce qu'un logiciel en tant que dispositif médical ?
- Comment savoir si votre application mobile est un SaMD ?
- Facteurs à prendre en compte pour la caractérisation SaMD
- Quels sont les exemples de logiciels en tant que dispositifs médicaux ?
- Comment classez-vous le logiciel comme dispositif médical ?
- Que peuvent faire les fabricants de SaMD pour garantir la réglementation ?
- Conclusion
- FAQ sur SaMD
Qu'est-ce qu'un logiciel en tant que dispositif médical ?

La terminologie - Logiciel en tant que dispositif médical désigne tout logiciel destiné à être utilisé à une ou plusieurs fins médicales et qui remplit ces fonctions sans être intégré dans un dispositif médical matériel.
Voici comment l'IMDRAF définit SaMD -
« Le terme « logiciel en tant que dispositif médical » (SaMD) est défini comme un logiciel destiné à être utilisé à une ou plusieurs fins médicales qui accomplissent ces fins sans faire partie d'un dispositif médical matériel. »
Comment savoir si votre application mobile est un SaMD ?
- SaMD est un dispositif médical et comprend certains dispositifs médicaux de diagnostic in vitro (DIV).
- Il peut fonctionner sur des plates-formes informatiques à usage général (non médicales).
- Le logiciel ne répond pas à la définition de SaMD si son objectif est de piloter des dispositifs médicaux matériels .
- Il peut être utilisé avec d'autres produits tels que des dispositifs médicaux.
- Il peut être interfacé avec d'autres dispositifs médicaux, y compris des dispositifs médicaux matériels et d'autres logiciels SaMD, ainsi que des logiciels à usage général.
Facteurs à prendre en compte pour la caractérisation SaMD
Il existe deux façons de caractériser les SaMD :
Informations fournies par SaMD
- Diagnostiquer ou traiter les patients
- Informer la gestion clinique
- Piloter la gestion clinique
État de santé
- Un état critique
- Condition sérieuse
- Affection non grave
Sur la base de ces caractérisations, les SaMD sont divisés en quatre catégories.
Quels sont les exemples de logiciels en tant que dispositifs médicaux ?
- Le logiciel en tant que dispositif médical peut être interfacé avec d'autres gadgets médicaux, y compris des gadgets médicaux matériels et d'autres logiciels en tant que dispositif clinique, également en tant que logiciel à usage général. Un logiciel qui donne des limites devient l'entrée d'un équipement matériel différent ou d'un autre SaMD. Par exemple, un logiciel en tant qu'exemple de dispositif médical peut être un logiciel de planification de thérapie qui fournit des données utilisées dans un accélérateur linéaire est SaMD.
- Par exemple, un logiciel prévu pour l'analyse d'une condition utilisant l'accéléromètre triaxial qui fonctionne sur le processeur installé sur un appareil photo numérique grand public est considéré comme un logiciel en tant que dispositif médical.
- Un logiciel qui est connecté à un dispositif matériel médical mais qui n'est pas requis par ce dispositif pour accomplir son objectif médical est un logiciel en tant que dispositif médical et non un accessoire du dispositif médical.
- Le logiciel SMD peut fonctionner sur des plates-formes informatiques à usage général (c'est-à-dire pour des raisons non cliniques). Ces logiciels fonctionnant sur ces plates-formes informatiques à usage général pourraient être situés dans un gadget médical matériel.
Catégorie Wise Exemples de SaMD
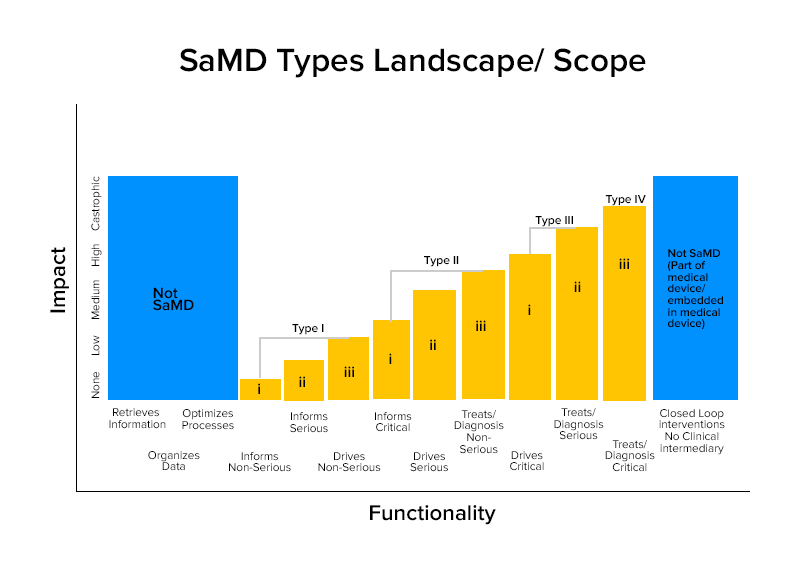
Catégorie IV :
- SaMDs qui effectuent une analyse d'image diagnostique pour permettre des décisions de traitement lorsque les patients souffrent d'un accident vasculaire cérébral aigu
- SaMDs qui calculent la dimension fractale d'une lésion et construisent une carte structurelle qui révèle différents schémas de croissance pour fournir un diagnostic ou une identification si la lésion est bénigne ou maligne.
- Les SaMD combinent les données des immunoessais pour dépister les épidémies d'agents pathogènes mutables qui peuvent être hautement transmissibles.
Catégorie III :

- SaMD qui utilise le microphone du téléphone pour détecter une respiration interrompue pendant le sommeil.
- Il est utilisé pour fournir des informations en cliquant sur des images, en surveillant la croissance ou d'autres données pour compléter d'autres informations qu'un fournisseur de soins de santé utilise pour diagnostiquer si une lésion cutanée est bénigne ou maligne.
Catégorie II :
- SaMDs qui analyse la fréquence cardiaque.
- SaMD qui utilise les données des dossiers de santé des individus pour prédire les risques de maladie cardiaque ou d'accident vasculaire cérébral et créer des stratégies de prévention.
- SaMD qui intègre et analyse de multiples tests pour proposer des recommandations de diagnostic dans certaines indications cliniques.
Catégorie I :
- Dispositifs médicaux logiciels qui recueillent des données à partir de journaux de symptômes pour fournir des informations permettant d'évaluer la survenue d'un épisode d'asthme.
- Dispositifs médicaux logiciels analysant les images, le mouvement de l'œil pour guider la prochaine action de diagnostic de l'astigmatisme.
- Logiciels qui stockent des informations historiques sur la tension artérielle pour que les prestataires de soins de santé puissent les examiner.
- Logiciels utilisant des données de sensibilité auditive, de parole dans le bruit et demandant aux utilisateurs de répondre à des questionnaires sur des situations d'écoute courantes pour l'auto-évaluation de la perte auditive.
Comment classez-vous le logiciel comme dispositif médical ?
Le nouveau MDR de l'UE (le règlement de l'Union européenne sur les dispositifs médicaux) donne des définitions, des règles, des classifications et des nécessités procédurales pour les normes logicielles des dispositifs médicaux.
L'annexe VIII du RDM de l'UE parle de divers logiciels en tant que règles de classification des dispositifs médicaux.
La règle 11 de l'annexe VIII concerne la classification des logiciels et traite spécifiquement de la classification des logiciels utilisés seuls ou en combinaison avec des dispositifs médicaux.
Les logiciels destinés à fournir des données qui sont utilisées pour faire des choix en termes de diagnostic ou à des fins thérapeutiques sont classés dans la classe IIa, sauf si ces choix ont un effet pouvant entraîner la mort ou une détérioration irréversible de la santé d'un individu. Dans de tels cas, il s'agit de la classe III ou d'une grave détérioration de l'état de santé d'un individu ou d'une intervention chirurgicale, auquel cas il est classé dans la classe IIb.
Les logiciels censés dépister des processus physiologiques relèvent de la classe IIa, sauf s'ils sont proposés pour l'observation de paramètres physiologiques essentiels, lorsque la nature des variétés de ces paramètres est telle qu'elle pourrait entraîner une menace immédiate pour le patient, auquel cas il est nommée classe IIb. Tous les autres logiciels restants sont délégués en classe I.
Par exemple, les logiciels utilisés pour dépister les fréquences cardiaques ou certains autres paramètres physiologiques lors d'un examen de routine relèvent de la classe IIa. Si par hasard la surveillance porte sur des paramètres physiologiques impératifs, et lorsque ces paramètres pourraient entraîner un péril immédiat pour le patient, le classement est élevé à la classe IIb.
Que peuvent faire les fabricants de SaMD pour garantir la réglementation ?
Les entreprises SaMD doivent avoir un bon système de gestion de la qualité intégré au processus de développement pour garantir la conformité à toute réglementation. La plate-forme QMS choisie doit être capable de se conformer aux exigences réglementaires telles que FDA 21 CFR Part 820 et ISO 13485:2016.
Tout faux pas dans la direction peut entraîner de graves conséquences, l'interdiction de votre application n'étant que le point de basculement. Compte tenu de l'importance cruciale, il est conseillé de vous associer à une société de développement de logiciels de soins de santé personnalisés qui travaille aux côtés de médecins qui comprennent ces réglementations et conformités dans leur intégralité.
Conclusion
Les sociétés de développement d'applications de soins de santé aux États-Unis qui développent actuellement des logiciels à utiliser avec des dispositifs médicaux ou en tant que dispositifs médicaux autonomes doivent être conscientes de ces changements et s'assurer de mettre en œuvre les mesures pour s'assurer que leur logiciel est conforme au nouveau régime.

FAQ sur SaMD
Q. Quels sont les exemples de logiciels qui ne sont pas SaMD ?
- Applications dont les dispositifs médicaux matériels ont besoin pour jouer leur rôle.
- Applications qui dépendent des données du dispositif médical.
- Applications qui permettent la communication et la rationalisation du flux de travail clinique, comme celles pour planifier des visites, des appels vidéo ou vocaux, etc.
Les exemples d'applications ne se limitent pas à ceux-ci. Il existe un certain nombre d'autres types d'applications qui ne relèvent pas de la définition des SaMD.
Q. Que peut réellement faire un logiciel en tant que dispositif médical ?
Les applications SaMD sont celles qui agissent comme une application de santé autonome qui donne aux utilisateurs un aperçu de leur santé physique en établissant un diagnostic, en effectuant un traitement aux rayons X ou en calculant les doses d'insuline.
Q. Qu'est-ce que la CEI 62304 ?
La CEI 62304 est une norme qui spécifie les exigences de cycle de vie nécessaires à la création d'un logiciel en tant que dispositif médical et d'un logiciel dans les dispositifs médicaux. Lorsqu'il est utilisé avec l'ISO 13485, il offre un cadre important pour la conception et la maintenance sûres des logiciels de dispositifs médicaux.
Q. Décrivez votre processus QMS pour le développement de logiciels pour dispositifs médicaux
Nous avons notre propre système de gestion de la qualité interne pour travailler avec les clients des dispositifs médicaux et pharmaceutiques, afin d'assurer notre propre qualité. Nous ne sommes pas audités par des clients, des tiers ou des régulateurs.
Étape 1 : Lancer le projet : Organiser une téléconférence de lancement avec le client pour :
Examiner le plan et le calendrier du projet
Finaliser les principales sources d'information
Définir l'équipe projet
Étape 2 : Examen de la documentation : Évaluez et examinez tous les documents pertinents, y compris les informations existantes sur les produits, les données/plans non cliniques et la documentation réglementaire. Les sources de ces informations sont :
Données non cliniques, correspondance réglementaire, spécifications techniques des produits, références aux dispositifs sous-jacents, revendications de produit proposées et intentions/indications d'utilisation, etc.
Étape 3 : Déterminer la voie réglementaire En utilisant les informations de la section ci-dessus, développez une voie réglementaire FDA déterminant si 510(k) ou de novo est le plus approprié (une stratégie réglementaire PMA est plus complexe et nécessitera un budget plus élevé). L'objectif sera de conseiller le client sur l'approche optimale de la FDA.
