Il software come dispositivo medico: definizione e ambito di applicazione della normativa
Pubblicato: 2019-09-06Negli ultimi 40 anni, il numero di innovazioni tecnologiche sia all'interno che intorno ai dispositivi medici è aumentato notevolmente. In particolare, gli ultimi 20 anni hanno assistito a un'accelerazione nel settore, grazie all'Internet delle cose e all'aumento delle sue altre parti corrispondenti come connettività wireless, cloud computing e intelligenza artificiale, ecc. Questi progressi hanno trasformato i processi sanitari.
Anche dopo 20 anni, queste tecnologie all'avanguardia continuano a causare un cambiamento sismico nel processo di somministrazione e consegna dell'assistenza sanitaria.
E ora, anche le applicazioni mobili si sono infiltrate e sono diventate una parte importante di questi scopi medici e non medici altamente richiesti e basati sulla tecnologia.
Queste app o software che sono un dispositivo medico a sé stante - Le dimensioni del mercato del software come dispositivo medico sono cresciute fino a diventare una parte intrinseca della vita degli utenti. Le applicazioni della SaMD non si limitano solo alla diagnosi, ma hanno anche trovato il loro posto nel processo di monitoraggio e trattamento. Infatti è SaMD che ha portato all'evoluzione dell'assistenza sanitaria 1.0 verso l'assistenza sanitaria 3.0 .
Vedendo la crescente inclusione di SaMD nell'assistenza sanitaria quotidiana , il forum internazionale dei regolatori dei dispositivi medici (IMDRF), di cui la FDA statunitense è membro, ha descritto in dettaglio il concetto e le categorie di rischio SaMD che il settore dello sviluppo di app mediche deve seguire. Il software FDA come dispositivo medico ha sviluppato e chiarito politiche basate sul rischio per una migliore comunicazione dei requisiti e ha allineato il suo approccio normativo alla natura in evoluzione dei dispositivi digitali.
* SaMD non è l'unica conformità che le parti interessate del settore sanitario: gli imprenditori di applicazioni mHealth e i produttori di dispositivi dovrebbero seguire. Esistono anche altre conformità, come FDA, HIPAA, HL7 e FCPA. Abbiamo affrontato queste conformità in modo molto dettagliato nella nostra In questo articolo, faremo luce su SaMD, sul software come regolamento per dispositivi medici e sui tipi di app mHealth e altri tipi di software medico classificati come Software come dispositivo medico.
Tabella dei contenuti
- Che cos'è il software come dispositivo medico?
- Come sapere se la tua app mobile è un SaMD?
- Fattori da considerare per la caratterizzazione SaMD
- Quali sono esempi di software come dispositivo medico?
- Come si classifica il software come dispositivo medico?
- Cosa possono fare i produttori SaMD per garantire le normative?
- Conclusione
- Domande frequenti su SaMD
Che cos'è il software come dispositivo medico?

La terminologia - Software come dispositivo medico indica qualsiasi software destinato all'uso per uno o più scopi medici e che esegue tali scopi senza essere integrato in un dispositivo medico hardware.
Ecco come IMDAF definisce SaMD –
"Il termine "Software come dispositivo medico" (SaMD) è definito come un software destinato a essere utilizzato per uno o più scopi medici che svolgono tali scopi senza far parte di un dispositivo medico hardware."
Come sapere se la tua app mobile è un SaMD?
- SaMD è un dispositivo medico e include alcuni dispositivi medici diagnostici in vitro (IVD).
- È in grado di funzionare su piattaforme informatiche generiche (non mediche).
- Il software non soddisfa la definizione di SaMD se lo scopo previsto è quello di pilotare dispositivi medici hardware .
- Può essere utilizzato con altri prodotti come i dispositivi medici.
- Può essere interfacciato con altri dispositivi medici, inclusi dispositivi medici hardware e altri software SaMD, nonché software generici.
Fattori da considerare per la caratterizzazione SaMD
Ci sono due modi attraverso i quali i SaMD sono caratterizzati:
Informazioni fornite da SaMD
- Per diagnosticare o curare i pazienti
- Informare la gestione clinica
- Per guidare la gestione clinica
Condizione sanitaria
- Condizione critica
- Condizione grave
- Condizione non grave
Sulla base di queste caratterizzazioni, i SaMD sono suddivisi in quattro categorie.
Quali sono esempi di software come dispositivo medico?
- Il software come dispositivo medico può essere interfacciato con altri gadget medici, inclusi gadget medici hardware e altri software come dispositivo clinico, anche come software di uso generale. Il software che definisce i limiti diventa l'input per una diversa apparecchiatura hardware o altro SaMD. Ad esempio, il software come esempio di dispositivo medico può essere un software di pianificazione della terapia che fornisce i dati utilizzati in un acceleratore lineare è SaMD.
- Ad esempio, il software previsto per l'analisi di una condizione che utilizza l'accelerometro triassiale che funziona sul processore installato su una fotocamera digitale consumer è visto come software come dispositivo medico.
- Il software collegato a un dispositivo hardware medico ma non richiesto da tale dispositivo per raggiungere il suo scopo medico è un software come dispositivo medico e non un accessorio del dispositivo medico.
- Il software SMD è in grado di funzionare su piattaforme informatiche per scopi generici (ovvero ragioni non cliniche). Questi software in esecuzione su queste piattaforme informatiche generiche potrebbero trovarsi in un gadget medico hardware.
Categoria Esempi saggi di SaMD
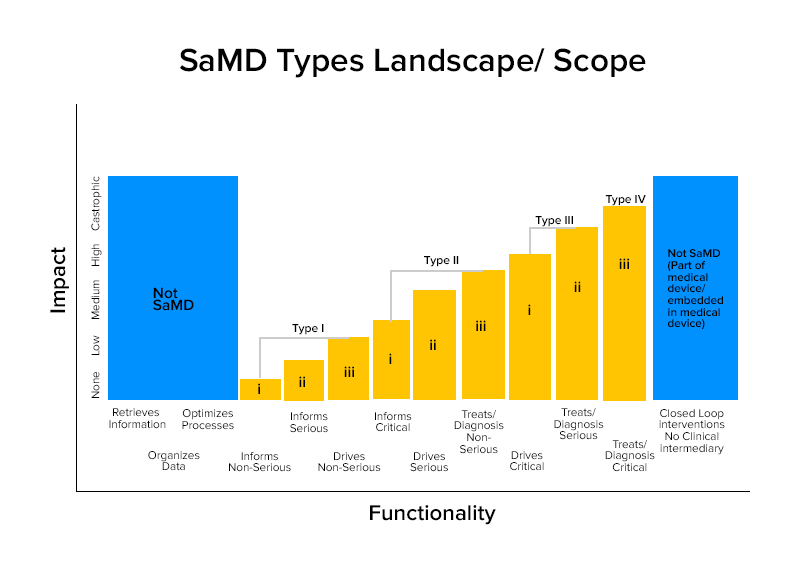
Categoria IV:
- SaMD che eseguono l'analisi diagnostica dell'immagine per consentire decisioni terapeutiche quando i pazienti subiscono un ictus acuto
- SaMD che calcolano la dimensione frattale di una lesione e costruiscono una mappa strutturale che rivela diversi modelli di crescita per fornire diagnosi o identificazione se la lesione è benigna o maligna.
- I SaMD combinano i dati dei test immunologici per lo screening di focolai di agenti patogeni mutevoli che possono essere altamente trasmissibili.
Categoria III:

- SaMD che utilizza il microfono del telefono per rilevare la respirazione interrotta durante il sonno.
- Viene utilizzato per fornire informazioni facendo clic su immagini, monitorando la crescita o altri dati per integrare altre informazioni che un operatore sanitario utilizza per diagnosticare se una lesione cutanea è benigna o maligna.
Categoria II:
- SaMD che analizza la frequenza cardiaca.
- SaMD che utilizza i dati delle cartelle cliniche degli individui per prevedere i rischi di malattie cardiache o ictus e creare strategie di prevenzione.
- SaMD che integrano e analizzano più test per offrire raccomandazioni per la diagnosi in determinate indicazioni cliniche.
Categoria I:
- Dispositivi medici software che raccolgono dati dai diari dei sintomi per fornire informazioni per valutare l'occorrenza di un episodio di asma.
- Software Dispositivi medici che analizzano le immagini, il movimento dell'occhio per guidare la prossima azione diagnostica per l'astigmatismo.
- Software che memorizzano le informazioni storiche sulla pressione sanguigna che gli operatori sanitari possono rivedere.
- Software che utilizzano dati di sensibilità uditiva, parlato nel rumore e chiedono agli utenti di rispondere a questionari sulle situazioni di ascolto comuni per l'autovalutazione della perdita dell'udito.
Come si classifica il software come dispositivo medico?
Il nuovo EU MDR (The European Union Medical Device Regulation) fornisce definizioni, regole, classificazioni e necessità procedurali per gli standard dei software dei dispositivi medici.
L'allegato VIII dell'MDR dell'UE parla di vari software come regole di classificazione dei dispositivi medici.
La regola 11 dell'allegato VIII riguarda la classificazione del software e riguarda specificamente la classificazione del software utilizzato da solo o in combinazione con dispositivi medici.
I software progettati per fornire dati che vengono utilizzati per effettuare scelte in termini di diagnosi o finalità terapeutiche sono classificati di Classe IIa, a prescindere dal fatto che tali scelte abbiano un effetto che può causare la morte o un deterioramento irreversibile della salute dell'individuo. In tali casi è in Classe III o un grave deterioramento delle condizioni di salute di un individuo o un intervento chirurgico, nel qual caso è classificato come Classe IIb.
Il software previsto per lo screening dei processi fisiologici è delegato come Classe IIa, con l'eccezione se è proposto per l'osservazione di parametri fisiologici essenziali, laddove la natura delle varietà di tali parametri è tale da poter comportare una minaccia immediata per il paziente, nel qual caso è denominata Classe IIb. Tutti gli altri software rimanenti sono delegati come Classe I.
Ad esempio, il software utilizzato per lo screening della frequenza cardiaca o di alcuni altri parametri fisiologici durante un controllo di routine è delegato come Classe IIa. Se per caso il monitoraggio si concentra su parametri fisiologici imperativi, e laddove tali parametri possano comportare un pericolo immediato per il paziente, la classificazione viene elevata alla Classe IIb.
Cosa possono fare i produttori SaMD per garantire le normative?
Le aziende SaMD dovrebbero avere un buon sistema di gestione della qualità incorporato nel processo di sviluppo per garantire la conformità a qualsiasi regolamento. La piattaforma QMS scelta dovrebbe essere in grado di soddisfare i requisiti normativi come FDA 21 CFR Part 820 e ISO 13485:2016.
Qualsiasi passo falso nella direzione può portare a gravi conseguenze con il divieto della tua applicazione che è solo il punto di svolta. Notando l'importanza, si consiglia di collaborare con una società di sviluppo di software sanitario personalizzato che lavora al fianco di medici che comprendono queste normative e conformità nella loro interezza.
Conclusione
Le società di sviluppo di app sanitarie negli Stati Uniti che stanno attualmente sviluppando software da utilizzare in connessione con dispositivi medici o come dispositivo medico autonomo, dovrebbero essere consapevoli di questi cambiamenti e assicurarsi di implementare le misure per garantire che il loro software sia conforme al nuovo regime.

Domande frequenti su SaMD
D. Quali sono esempi di software che non sono SaMD ?
- App di cui i dispositivi medici hardware hanno bisogno per svolgere il proprio ruolo.
- App che dipendono dai dati del dispositivo medico.
- App che consentono la comunicazione e lo snellimento del flusso di lavoro clinico, come quelle per la pianificazione di visite, chiamate video o vocali, ecc.
Gli esempi di app non si limitano a questi. Esistono numerosi altri tipi di app che non rientrano nella definizione di SaMD.
D. Cosa può fare effettivamente il software come dispositivo medico?
Le applicazioni SaMD sono quelle che agiscono come un'applicazione sanitaria autonoma che offre agli utenti la visione della loro salute fisica effettuando diagnosi, eseguendo l'elaborazione dei raggi X o calcolando le dosi di insulina.
D. Che cos'è la norma IEC 62304?
IEC 62304 è una norma che specifica i requisiti del ciclo di vita necessari per la creazione di software come dispositivo medico e software all'interno di dispositivi medici. Se utilizzato insieme a ISO 13485, offre un framework importante per la progettazione e la manutenzione sicure del software dei dispositivi medici.
D. Descrivi il tuo processo QMS per lo sviluppo di software per dispositivi medici
Abbiamo il nostro SGQ interno per lavorare con dispositivi medici e clienti farmaceutici, per garantire la nostra qualità. Non veniamo controllati da clienti, terze parti o autorità di regolamentazione.
Fase 1 : Avviare il progetto: condurre una teleconferenza iniziale con il cliente per:
Rivedere il piano del progetto e la tempistica
Finalizzare le principali fonti di informazione
Definisci il team di progetto
Fase 2 : Revisione della documentazione: valutare ed esaminare tutti i documenti pertinenti, comprese le informazioni sui prodotti esistenti, i dati/piani non clinici e la documentazione normativa. Le fonti di queste informazioni sono:
Dati non clinici, corrispondenza normativa, specifiche tecniche del prodotto, riferimenti a dispositivi di riferimento, dichiarazioni di prodotto proposte e destinazione/indicazioni per l'uso, ecc.
Fase 3 : Determinare il percorso normativo Utilizzando le informazioni della sezione precedente, sviluppare un percorso normativo FDA per determinare se 510(k) o de novo è il più appropriato (una strategia normativa PMA è più complessa e richiederà un budget più elevato). L'obiettivo sarà di consigliare il Cliente sull'approccio ottimale alla FDA.
