Kieszonkowy przewodnik po zgodności z przepisami dotyczącymi opieki zdrowotnej
Opublikowany: 2020-06-26Opieka zdrowotna jest jednym z dominujących sektorów, który jest bombardowany technologiami cyfrowymi w celu modernizacji infrastruktury i usług.
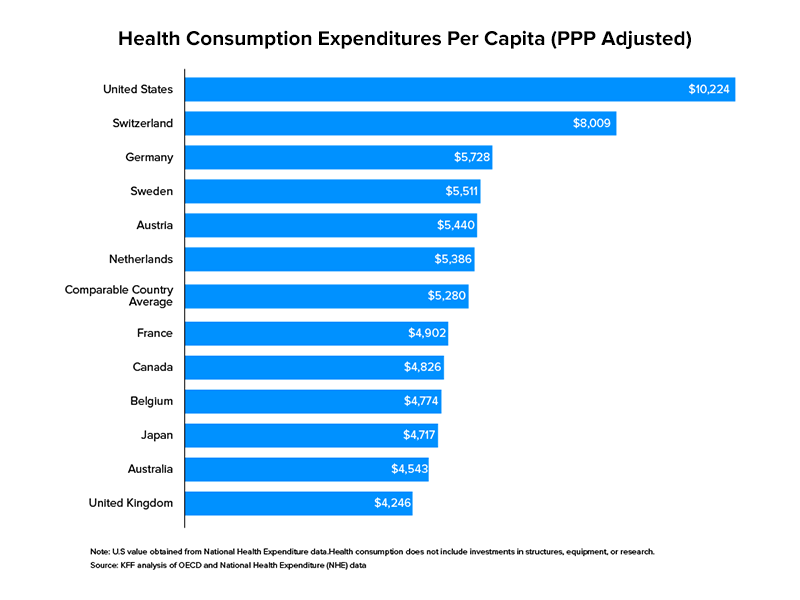
Biorąc pod uwagę wydatki instytucjonalne jako miernik, opieka zdrowotna przewyższa wydatki rządu USA w znacznej mierze w porównaniu z innymi sektorami. W 2017 roku Stany Zjednoczone przeznaczyły 3,5 biliona dolarów na opiekę zdrowotną. Jako udział w PKB kraju wyniósł 17,7 proc . Opieka zdrowotna w Stanach Zjednoczonych nie jest obszarem ograniczonym do tradycyjnych firm z mnóstwem kapitału do inwestowania i rozwoju, ale otwartym dla wszystkich na uczestnictwo.
Cyfrowe zdrowie to rozwijająca się perspektywa tej branży, która obejmuje modele biznesowe, takie jak telezdrowie, zdalne monitorowanie za pomocą aplikacji na smartfony i dostarczanie leków na receptę do domu. Tylko w 2019 r. startupy opowiadające się za przyjęciem cyfrowej opieki zdrowotnej zebrały ponad 17 miliardów dolarów w ponad 1700 transakcjach w Stanach Zjednoczonych. Zgodnie z oczekiwaniami w związku z trwającą zmianą, rozwój mobilnej opieki zdrowotnej zajmuje centralne miejsce.
Opracowanie produktu, który rzekomo wpływa/poprawia higienę osobistą, jest trudnym orzechem do zgryzienia, nie z powodu wyzwań związanych z tworzeniem oprogramowania dla opieki zdrowotnej , ale z powodu wytycznych powierniczych.
Appinventiv jest w czołówce tej zmiany, pulsując sercem branży dzięki naszym partnerom. Jako firma zajmująca się tworzeniem aplikacji dla służby zdrowia byliśmy tam i zrobiliśmy to, co było konieczne, aby wcielić w życie przełomowe pomysły. Jako Twój powiernik, dzisiaj będziemy omawiać wspólne przepisy i zgodność, o których należy pamiętać podczas tworzenia aplikacji mHealth .
Co to jest zgodność z przepisami dotyczącymi opieki zdrowotnej?
Zgodność z przepisami w opiece zdrowotnej dotyczy przestrzegania przez stowarzyszenie medyczne praw, wytycznych, przepisów i specyfikacji mających zastosowanie do jego procesów biznesowych. Naruszenie zgodności z przepisami regularnie pociąga za sobą kary prawne, w tym grzywny federalne. Jest to ciągły cykl spełniania lub przekraczania zgodnych z prawem, moralnych i zawodowych norm właściwych dla konkretnego stowarzyszenia opieki zdrowotnej lub dostawcy.
Obecnie firmy opieki zdrowotnej, takie jak szpitale i świadczeniodawcy opieki zdrowotnej, mają oddanych członków zespołu, którzy szczególnie koncentrują się na zgodności z przepisami. Powodem i zasadniczą zaletą wymogów regulacyjnych dla szpitali jest poprawa opieki nad pacjentem.
Jaki jest cel przestrzegania przepisów w opiece zdrowotnej?
Zgodność z przepisami dotyczącymi opieki zdrowotnej jest podstawowym segmentem każdego dostawcy usług medycznych. Jest to sposób na przestrzeganie zasad, wytycznych, praw i przepisów związanych z praktyką opieki zdrowotnej.
Compliance w opiece zdrowotnej obejmuje szeroki wachlarz praktyk i przestrzega wewnętrznych i zewnętrznych zasad. Jednak większość problemów dotyczących zgodności usług medycznych dotyczy bezpieczeństwa pacjentów, ochrony danych pacjentów i prób rozliczeń.
Amerykański Oddział Zdrowia i Opieki Społecznej (HHS) opracował ogólnokrajowe standardy znane jako Ustawa o przenośności i odpowiedzialności w ubezpieczeniach zdrowotnych (HIPAA), a główną cechą zgodności medycznej jest przestrzeganie tych przepisów.
Dlaczego zgodność z przepisami dotyczącymi opieki zdrowotnej jest ważna?
Zgodność zapewnia płynne działanie zadań i zapewnia, że wszyscy przestrzegają zgodnych z prawem procedur i rozumieją założenia.
Jednak zgodność w usługach medycznych wiąże się ze znacznie wyższymi stawkami niż w innych branżach. Z drugiej strony, jeśli lekarze, tacy jak lekarze i pielęgniarki, nie zastosują się do zgodnej z prawem procedury, mogą skończyć się szkodą dla pacjenta lub innego członka personelu.
Ostatecznie zgodność w zakresie opieki zdrowotnej polega na zapewnieniu bezpiecznej, wysokiej jakości opieki nad pacjentem. Przestrzeganie standardów i przepisów branżowych pomaga organizacjom opieki zdrowotnej w dalszym podnoszeniu jakości opieki.
Wreszcie zgodność opieki medycznej polega na zapewnieniu pacjentom bezpiecznej, wysokiej jakości i bezpiecznej opieki. Przestrzeganie wytycznych i przepisów branżowych pomaga organizacjom opieki zdrowotnej w ciągłym podnoszeniu jakości opieki.
Organizacje opieki zdrowotnej podlegają surowym wytycznym, ustawom i regulacjom rządowym. Naruszenie tych przepisów może skutkować procesami sądowymi, wysokimi grzywnami, a nawet utratą licencji.
Co to jest wysokie ryzyko problemów ze zgodnością?
Ramy regulacyjne służą jako model wykorzystywany do nakładania sankcji na wytyczne. Takie struktury mogą być tworzone w wyraźnych obszarach zainteresowania, takich jak branża opieki zdrowotnej. Rządy często polegają na wykorzystaniu takich ram do tworzenia i uchwalania wytycznych, zasad i praw. Ramy regulacyjne są zwykle najpierw opracowywane z uwzględnieniem celu końcowego.
Przyjrzyjmy się głównemu pytaniu, które nurtuje wszystkich, czyli czym są kwestie zgodności w opiece zdrowotnej?
HIPAA i naruszenia danych
Ustalenia wynagrodzeń oparte na wartości
Kwestie antyodrzutowe i problemy ze szpitalem
Procesy należytej staranności
Kwalifikacje dostawcy telezdrowia
Wykonawcy audytu windykacyjnego
Szpitale zwolnione z podatku i wymagania dotyczące zgodności
Przepisy dotyczące opieki zdrowotnej i zgodność w USA
Cyfrowe zdrowie ma rozbudowane restrykcje, wskazujące na nakazy i zakazy dotyczące technologii informacyjnej w zakresie zdrowia (HIT), zdrowia mobilnego, spersonalizowanych recept, technologii do noszenia i telezdrowia. Aplikacje mobilne to jeden z najczęstszych sposobów świadczenia opieki zdrowotnej , czy to za pośrednictwem usługi online offline, czy oprogramowania jako usługi. W takim przypadku przedsiębiorcy muszą zadać następujące pytania i znaleźć na nie obiektywne odpowiedzi:

Powyższy kwestionariusz określiłby, czy Twoja aplikacja mobilna wymaga zgody powierniczej, czy nie. Pod warunkiem, że Twoje odpowiedzi były w większości tak, istnieją trzy organy federalne, które zajmą się sprawą Twojego produktu m-zdrowia:
- Agencja ds. Żywności i Leków (FDA)
- Federalna Komisja Handlu (FTC)
- Biuro Praw Obywatelskich (OCR)
Poniżej przyjrzymy się kluczowym federalnym obszarom funkcji oraz zakresowi szczegółowego sprawdzania faktów, w których firma tworząca oprogramowanie dla opieki zdrowotnej musi doradzać swoim klientom.
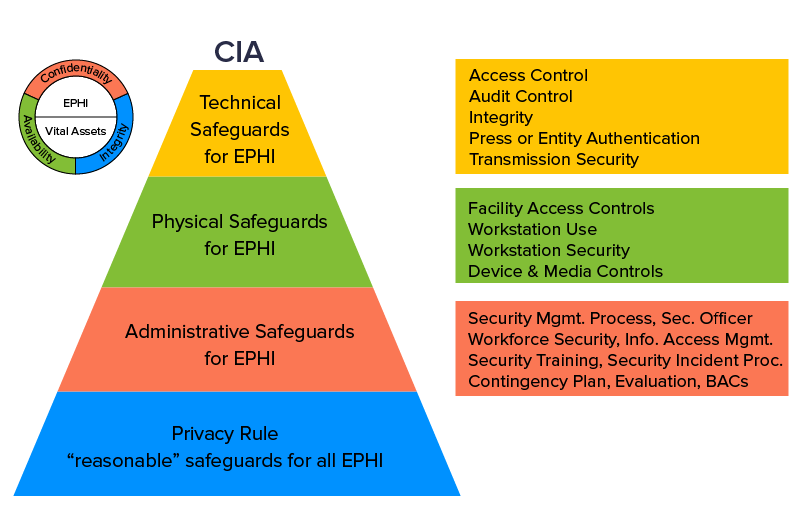
1. Ustawa o przenośności i odpowiedzialności w ubezpieczeniach zdrowotnych (HIPAA)
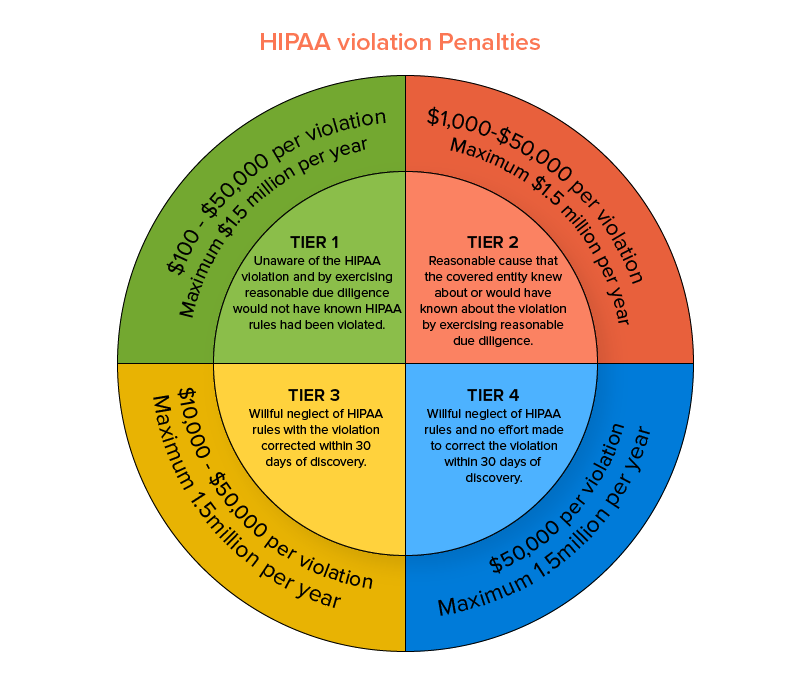
Ustawa ta jest egzekwowana przez Biuro Praw Obywatelskich (OCR) w Departamencie Zdrowia i Opieki Społecznej Stanów Zjednoczonych. Ta medyczna zasada bezpieczeństwa HIPAA zgodna z wymogami medycznymi chroni prywatność i bezpieczeństwo kwalifikujących się danych związanych ze zdrowiem, a w szczególnych przypadkach uznaje, że zgłaszanie naruszeń danych jest obowiązkowe. Nieprzestrzeganie określonej zasady bezpieczeństwa HIPAA może skutkować karami począwszy od minimalnej płatności w wysokości 100 USD i wzrosnąć do 1,5 miliona USD na podstawie naruszenia na każdy incydent.
Teraz, gdy masz już wyczuwalne pojęcie, z jaką powagą podchodzimy do wymogów przepisów dotyczących opieki zdrowotnej , powinniśmy przejść i przyjrzeć się rodzajom aplikacji medycznych, które powinny być zgodne z tradycyjnymi zasadami HIPAA. Trzy trzy czynniki regulują kryteria kwalifikacji określone w celu wyróżnienia aplikacji jako medycznej pod względem operacyjnym:
I. Charakter podmiotu korzystającego z aplikacji.
Podmiot odnosi się do klienta, który będzie korzystał z aplikacji. Istnieje zestaw predefiniowanych lekarzy, którzy są objęci konstytucją HIPAA, takich jak lekarze, lekarze, organizacje takie jak szpitale i ubezpieczyciele zdrowotni. Jeśli są bezpośrednimi beneficjentami aplikacji, wówczas lista przepisów dotyczących opieki zdrowotnej i zgodności z przepisami szpitalnymi HIPAA będzie musiała być przestrzegana słowo w słowo. Z drugiej strony, jeśli aplikacja po prostu kuratoruje i dzieli się z klientem wskazówkami higienicznymi lub wiedzą o zdrowiu, będzie to zwolnione z konstytucji HIPAA.
II. Charakter danych, które aplikacja generuje, przechowuje i dalej udostępnia.
Dane mają kluczowe znaczenie dla potrzeb funkcjonowania firm internetowych. Władze federalne naciskają na przepisy, które negują obawy związane z bezpieczeństwem, takie jak naruszenia danych, i zapewniają obecność solidnej infrastruktury szyfrowania. Zasadniczo zebrane dane nie powinny i nie mogą prowadzić złośliwych aktorów do ludzi za pośrednictwem ich danych osobowych, takich jak adres, numer ubezpieczenia społecznego itp. Jeśli aplikacja ma zajmować się korzystaniem z takich osobistych punktów kontrolnych, wówczas zasady HIPAA zaaplikuje.

III. Podstawowe oprogramowanie, które obsługuje aplikację.
Tworzenie najlepszych aplikacji mobilnych dla służby zdrowia musi koncentrować się na innowacjach w bezpiecznej aplikacji na telefon. HIPAA dzieli się szczegółami Chronionych Informacji Zdrowotnych (PHI) i nakazuje sprzedawcom oprogramowania, aby zbudowali wokół niego siatkę bezpieczeństwa. Jej dyrektywy zawierają szczegółową listę kontrolną audytów i kontroli wewnętrznych, które należy zainstalować dla PHI.
2. Ustawa o Federalnej Komisji Handlu (Ustawa FTC)
Ustawa ta narzuca protokoły regulacyjne mające na celu radzenie sobie z nieuczciwymi roszczeniami i nadużyciami w przedsiębiorstwach, również w odniesieniu do kwestii prywatności i ogólnych wyzwań związanych z bezpieczeństwem danych. Nieuzasadnione roszczenia dotyczące korzystania z aplikacji są objęte tym prawem. Zasada powiadamiania o naruszeniu zdrowia FTC nakazuje wybranym firmom zgłaszanie naruszeń danych, takich jak osobista dokumentacja zdrowotna.
3. Federalna ustawa o żywności, lekach i kosmetykach (ustawa FD&C)
Wdrożenie tej ustawy powierzono Agencji ds. Żywności i Leków. Ich głównym celem jest zapewnienie, że urządzenia medyczne, w tym aplikacje mobilne, spełniają standardowe wytyczne, a tym samym są bezpieczne do masowego spożycia. Najważniejsze jest, aby wspomnieć, że nie wszystkie aplikacje opieki zdrowotnej podlegają tej jurysdykcji, ale tylko kilka. Są to te, które w przypadku niedotrzymania roszczeń mogą mieć poważne konsekwencje dla zdrowia konsumentów.
Dodatkowe rozporządzenie Dla cyfrowego zdrowia
Chociaż powyższe akty były celowo ukierunkowanymi zastosowaniami opieki zdrowotnej, istnieją inne, które nie zostały wprowadzone z tego powodu, ale zostały dostosowane, aby uwzględnić to samo. W tej sekcji dokonamy przeglądu takich wspieranych przez państwo norm, których muszą przestrzegać przedsiębiorcy m-zdrowia.
1. Agencja ds. Żywności i Leków (FDA)
Food and Drug Administration to agencja wspierana przez rząd Stanów Zjednoczonych, która stanowi kluczowy element Departamentu Zdrowia i Opieki Społecznej Stanów Zjednoczonych. Twórcy aplikacji dla służby zdrowia muszą przestrzegać takiego zestawu dobrze zdefiniowanych wytycznych podczas projektowania aplikacji, aby uzyskać zgodę FDA. W przypadku cyfrowego sektora zdrowia FDA kategoryzuje aplikacje mobilne na „medyczne” płyty w oparciu o następujące dwa postulaty:

- Aplikacja jest używana jako akcesorium obok lub razem z już regulowanym urządzeniem medycznym.
- Aplikacja przekształca platformę mobilną w regulowane urządzenie mobilne
W oparciu o wyżej wspomnianą klasyfikację pierwszego poziomu, podsektor aplikacji jest definiowany na podstawie jego związku z następującymi nowymi technologiami cyfrowymi, aby przybliżyć się do zatwierdzenia przez FDA.
I. Oprogramowanie jako wyrób medyczny (SaMD)
SaMD definiuje się jako model, w którym oprogramowanie jest wykorzystywane do celów medycznych bez powiązania ze sprzętowym instrumentem/urządzeniem medycznym. Model jest bardzo elastyczny i można go zastosować na wielu platformach, od sieci wirtualnych po urządzenia medyczne.
Międzynarodowe Forum Regulatorów Urządzeń Medycznych (IMDRF) to globalna koalicja, która opowiada się za systematycznym zarządzaniem urządzeniami medycznymi. W 2013 roku sformułował oprogramowanie jako grupę roboczą urządzeń medycznych (SaMDWG), aby wprowadzić praktyczne wskazówki wspierające rozwój technologii cyfrowych w tym segmencie. Kierowana przez samą FDA grupa udokumentowała mnóstwo ram dotyczących:
- Definicje
- Kategoryzacja ryzyka
- System zarządzania jakością
- Ocena kliniczna
Przeglądanie ich katalogów pomoże ci określić, czy uzyskasz zatwierdzenie SaMD, czy nie.
II. Bezprzewodowe urządzenia medyczne
Odnosi się do urządzeń medycznych wyposażonych w możliwość przeprowadzania bezprzewodowej transmisji danych z ukośnikami informacyjnymi w celu ułatwienia świadczenia usług opieki zdrowotnej. Takie zestawy narzędzi wykorzystują częstotliwości radiowe do komunikacji, które mogą być transmitowane przez Wi-Fi, Bluetooth lub smartfon. Typowym przykładem, który można znaleźć w biurach korporacyjnych, są urządzenia do identyfikacji radiowej (RFID).

III. Telemedycyna
Informatyka zdrowotna jest podzielona na telemedycynę i telezdrowie w celu uproszczenia procesu uzyskiwania zgody FDA. Telezdrowie jest wyznaczone jako wykorzystanie telekomunikacji do promowania i wspierania funkcji związanych z opieką zdrowotną – które znalazło się jeszcze bardziej w centrum uwagi od wybuchu COVID-19 . Firma zajmująca się tworzeniem oprogramowania do opieki zdrowotnej na zamówienie może opracować aplikacje, które wykorzystują:
- Wideokonferencje na żywo (asynchroniczne)
- Przechowywanie i przekazywanie (asynchroniczne) Wideokonferencje
- Zdalne monitorowanie pacjenta (RPM)
- Mobilne zdrowie (m-zdrowie)
IV. Zdrowie IT
W tym przypadku lepiej zacytować definicję podaną przez federalne Biuro Rządowe Krajowego Koordynatora Informatyki Medycznej, „sprzęt, oprogramowanie, zintegrowane technologie lub powiązane licencje, własność intelektualną, aktualizacje lub pakiety rozwiązań sprzedawane jako usługi, które są przeznaczone lub wspierają wykorzystanie przez podmioty opieki zdrowotnej lub pacjentów do elektronicznego tworzenia, utrzymywania, dostępu lub wymiany informacji zdrowotnych.”
V. Systemy danych urządzeń medycznych (MDDS)
Produkty sprzętowe/programowe, których można używać do przesyłania danych, przechowywania/przechowywania informacji, konwertowania danych z jednego formatu na inny lub po prostu wyświetlania danych naukowych/medycznych, należą do kategorii MDDS. Celem takich urządzeń nie jest wnoszenie dodatkowych cech lub ulepszanie zbioru danych, ale po prostu jego wyświetlanie.
VI. Interoperacyjność urządzeń medycznych (MDI)
Prawdopodobnie nie ma innej subdomeny cyfrowego zdrowia, w której koncepcja bezpiecznej aplikacji na telefon wróżyłaby doskonale niż MDI. Interoperacyjność urządzeń medycznych odnosi się do międzyplatformowej/technologicznej wymiany informacji między wieloma urządzeniami. W przeciwieństwie do MDDS, gdzie głównym motywem jest prezentacja, aplikacje MDI mogą wyświetlać, przechowywać i analizować dane. W wyniku komunikacji tam i z powrotem mogą być również wykorzystywane do sterowania innymi produktami.
VII. Funkcje oprogramowania urządzenia
Mówiąc o tej kategorii, zezwolenie jest przyznawane tylko tym aplikacjom, które kwalifikują się jako „urządzenia” zgodnie z wytycznymi FDA. Urządzenia programowe, które mają minimalne lub zerowe ryzyko konsumpcji, mogą nie wymagać oficjalnej zgody FDA, a organizacja wyraźnie stwierdza, że w takich przypadkach
„ będzie postępować według uznania w zakresie egzekwowania prawa i nie będzie oczekiwać, że producenci złożą wnioski o przegląd przed wprowadzeniem na rynek ani zarejestrują i wymienią swoje oprogramowanie w FDA. ”
VIII. Bezpieczeństwo cybernetyczne
Cyberbezpieczeństwo samo w sobie nie jest sposobem klasyfikacji aplikacji m-zdrowia. Jednak FDA chce ustanowić jasny protokół ustaleń (MOU), aby móc porównać wyzwania związane z bezpieczeństwem danych, jakie aplikacja stwarza, z korzyściami dla użytkowników.
IX. Sztuczna inteligencja/uczenie maszynowe
Wpływ sztucznej inteligencji na opiekę zdrowotną jest nieproporcjonalnie ogromny w porównaniu z innymi technologiami. Jednak postęp w tym sektorze nastąpił stosunkowo niedawno, przez co FDA musiała wprowadzić zmiany w swoich ramach regulacyjnych. Zgodnie z najnowszymi wytycznymi FDA będzie współpracować z producentami w celu ciągłej oceny oprogramowania, począwszy od etapów rozwoju przed wprowadzeniem na rynek, a skończywszy na etapie wydajności po wprowadzeniu na rynek. Ramy dotyczą konkretnie SaMD.
2. Standardy HL7
Health Level Seven International, po prostu określany jako HL7, jest organizacją non-profit założoną w 1983 roku, która opracowuje standardy branżowe w zakresie wymiany, integracji, udostępniania i wyszukiwania elektronicznych informacji zdrowotnych, które umożliwiają proceduralną praktykę medyczną. Oprócz tego standardy HL7 odgrywają podstawową rolę w zarządzaniu służbą zdrowia, utrzymywaniu kursu na bezproblemową opiekę zdrowotną i ocenę wyników.
Jak oni to robią?
Standardy HL7 definiują opakowanie informacji, które ma być interoperacyjne między dwiema aplikacjami medycznymi, dyktując przepływ pracy dla języka, formatów danych i ich struktury, tak aby można je było łatwo zintegrować z systemami. W ten sposób zmniejszają inwestycje w infrastrukturę technologiczną i przynoszą korzyści pacjentom, czyniąc opiekę zdrowotną bardziej przystępną cenowo. Przestrzeganie opracowanych zasad, tak aby uzyskać aprobatę HL7, niesie ze sobą podwójne korzyści w zakresie regulacji sektora opieki zdrowotnej . Pierwsza aplikacja dla służby zdrowia jest powszechnie akceptowana i gotowa do wdrożenia na całym świecie. Po drugie, zmniejsza się koszt tworzenia aplikacji.
3. Ustawa HITECH
Ustawa o technologii informacyjnej w zakresie zdrowia ekonomicznego i klinicznego została wprowadzona podczas reżimu prezydenta Baracka Obamy w 2009 roku. Celem ustawy HITECH było promowanie przyjęcia przez przedsiębiorstwa technologii informacyjnej dotyczącej zdrowia za pośrednictwem elektronicznej dokumentacji medycznej (EHR). Administracja zacisnęła również luźne końce wokół ustawy HIPAA z 1996 roku, po której firmy opieki zdrowotnej stały się obowiązkowe informowanie klientów, czy i kiedy ich uprawnienia zostały naruszone.
Bezpośrednim skutkiem ustawy HITECH było to, że wymiana informacji między dwoma różnymi podmiotami stała się łatwiejsza w obsłudze dzięki EHR. Ustawa zapewniła również, że trudna do sforsowania infrastruktura bezpieczeństwa została zainstalowana zgodnie z wymogami ochrony prywatności i bezpieczeństwa określonymi w ustawie HIPAA. Wszystkie wymagania prawne, aby uzyskać aprobatę HITECH, zostały wpisane do HIPAA za pomocą ostatecznej zasady omnibusowej, co spowodowało, że oba akty zostały ułożone w jednym ustawodawstwie.
4. BYOD
Bring Your Own Device (BYOD) to koncepcyjna praktyka, w ramach której pracodawcy opieki zdrowotnej umożliwiają personelowi medycznemu korzystanie z urządzeń osobistych, takich jak smartfony i tablety, do wykonywania obowiązków służbowych. Sytuacja może się pogorszyć w jednej chwili, jeśli Twoje rozwiązanie mHealth nie jest dostosowane do protokołów bezpieczeństwa BYOD. Na przykład wyobraź sobie scenariusz, w którym pracownik traci swój smartfon, a urządzenie ma dostęp do krytycznych chronionych informacji zdrowotnych (PHI).
W tym miejscu w grę wchodzi mocno przemyślana strategia zarządzania urządzeniami mobilnymi. Jeśli twórcy aplikacji wbudowali w rozwiązanie mHealth funkcję zdalnego czyszczenia , możesz usunąć dane powiązane z utraconym urządzeniem. Podobne funkcje w ramach parasola BYOD obejmują zabezpieczanie aplikacji klienckich, takich jak wiadomości e-mail i przeglądarki. Zwrócenie uwagi na takie drobiazgi na początkowych etapach SDLC może w końcu pomóc startupom w uzyskaniu zatwierdzenia BYOD.
5. RODO
Ogólne rozporządzenie o ochronie danych zostało stworzone przez Unię Europejską (UE) i dotyczy aplikacji na smartfony, które gromadzą i przetwarzają dane klientów obywateli Unii Europejskiej. Gdy mówi się o podobnych iteracjach tego aktu w pracach poza granicami UE, uważa się, że jako środek bezpieczeństwa dla twórców aplikacji tworzenie rozwiązań m-zdrowia zgodnie z tym samym. Ochrona prywatności jest istotą RODO, poprzez którą władze federalne próbowały (z powodzeniem) przekazać laikowi część kontroli nad danymi osobowymi. Utrzymuje również otwarte praktyki biznesowe dotyczące zarządzania danymi prywatnymi.

Przepisy RODO wymagają od aplikacji mobilnych żądania zgody, czyli aktywnej zgody użytkownika , przed gromadzeniem lub przetwarzaniem jego danych. Aplikacja powinna ułatwiać użytkownikowi udostępnianie zgody za pomocą pola wyboru lub dowolnego innego przycisku, aby kliknąć i zarejestrować akcję. Dodatkowo, takie pola wyboru nie powinny być wcześniej zaznaczone, aby psychologicznie wpłynąć na wybór użytkownika, który musi pozostać bez przeszkód. Strona Regulamin musi mieć własny przycisk „Zgadzam się”. RODO w dużej mierze zdemokratyzowało kontrolę danych osobowych, ponieważ nawet po wyrażeniu zgody, użytkownicy mogą cofnąć wszystkie prawa przyznane aplikacji i odłączyć się od niej. Aktywacja zgody na RODO od władz byłaby stosunkowo łatwa, pod warunkiem, że firma zajmująca się tworzeniem aplikacji mobilnych opracuje rozwiązanie uwzględniające tę dyskusję.
Końcowe przemyślenia
Oczekuje się, że krajowe wydatki na opiekę zdrowotną osiągną 5,7 biliona dolarów do roku 2026 dzięki technologiom cyfrowym, takim jak m-zdrowie, telemedycyna, czujniki i technologie do noszenia oraz narzędzia do zdalnego monitorowania. Takie trendy w opiece zdrowotnej wskazują na marsz pod górę nigdy wcześniej nie widzianych rozwiązań medycznych, które zawierają technologię, aby natychmiast dotrzeć do społeczeństwa. Oczekuje się również, że zapewnią one wszystkim dostęp do opieki zdrowotnej jako podstawowego prawa, do którego należy, a nie usługi, z której można skorzystać. Skupiając się na biznesowej stronie przedsięwzięcia, pozwól, aby Appinventiv – jedna z najlepszych agencji zajmujących się opracowywaniem aplikacji medycznych w USA – była w trybie gotowości jako Twój przewodnik technologiczny.
Czekamy, aby usłyszeć twoje myśli.
