Oprogramowanie jako wyrób medyczny: definicja i zakres przepisów
Opublikowany: 2019-09-06Od ostatnich 40 lat liczba innowacji technologicznych, zarówno w obrębie urządzeń medycznych, jak i wokół nich, dramatycznie wzrosła. Zwłaszcza w ciągu ostatnich 20 lat nastąpiło przyspieszenie w sektorze dzięki Internetowi Rzeczy i rozwojowi jego innych odpowiednich elementów, takich jak łączność bezprzewodowa, przetwarzanie w chmurze i sztuczna inteligencja itp. Te postępy przekształciły procesy opieki zdrowotnej.
Nawet po 20 latach te najnowocześniejsze technologie nadal powodują zmiany sejsmiczne w procesie administrowania i dostarczania opieki zdrowotnej.
A teraz aplikacje mobilne również przeniknęły i stały się ważną częścią tych bardzo poszukiwanych, opartych na technologii celów medycznych i niemedycznych.
Te aplikacje lub oprogramowanie, które same w sobie są wyrobem medycznym — rozmiar rynku oprogramowania jako urządzenia medycznego urósł i stał się nieodłączną częścią życia użytkowników. Zastosowania SaMD nie ograniczają się tylko do diagnozy, ale również znalazły swoje miejsce w procesie monitorowania i leczenia. W rzeczywistości to SaMD doprowadziło do ewolucji opieki zdrowotnej 1.0 do opieki zdrowotnej 3.0 .
Widząc rosnące włączenie SaMD do codziennej opieki zdrowotnej, międzynarodowe forum regulatorów urządzeń medycznych (IMDRF), którego członkiem jest amerykańska FDA, szczegółowo opisało koncepcję i kategorie ryzyka SaMD dla branży rozwoju aplikacji medycznych. Oprogramowanie FDA jako urządzenie medyczne opracowało i wyjaśniło zasady oparte na ryzyku w celu lepszego komunikowania wymagań i dostosowało swoje podejście regulacyjne do ewoluującego charakteru urządzeń cyfrowych.
* SaMD nie jest jedyną zgodnością, której powinni przestrzegać interesariusze branży medycznej — przedsiębiorcy zajmujący się aplikacjami mHealth i producenci urządzeń. Istnieją również inne zgodności, takie jak FDA, HIPAA, HL7 i FCPA. Omówiliśmy te zgodności bardzo szczegółowo w naszym W tym artykule rzucimy trochę światła na SaMD, oprogramowanie jako regulację dotyczącą urządzeń medycznych oraz typy aplikacji mHealth i inne rodzaje oprogramowania medycznego, które są sklasyfikowane jako oprogramowanie jako urządzenie medyczne.
Spis treści
- Co to jest oprogramowanie jako urządzenie medyczne?
- Jak sprawdzić, czy Twoja aplikacja mobilna to SaMD?
- Czynniki, które należy wziąć pod uwagę przy charakterystyce SaMD
- Jakie są przykłady oprogramowania jako urządzenia medycznego?
- Jak klasyfikujesz oprogramowanie jako wyrób medyczny?
- Co mogą zrobić producenci SaMD, aby zapewnić przepisy?
- Wniosek
- Często zadawane pytania dotyczące SaMD
Co to jest oprogramowanie jako urządzenie medyczne?

Terminologia – Oprogramowanie jako wyrób medyczny oznacza wszelkie oprogramowanie, które jest przeznaczone do użytku w jednym lub wielu celach medycznych i które wykonuje te cele bez integracji ze sprzętowym wyrobem medycznym.
Oto jak IMDRAF definiuje SaMD –
„Termin »Oprogramowanie jako wyrób medyczny« (SaMD) definiuje się jako oprogramowanie przeznaczone do użytku w jednym lub większej liczbie celów medycznych, które spełniają te cele, nie będąc częścią sprzętowego wyrobu medycznego”.
Jak sprawdzić, czy Twoja aplikacja mobilna to SaMD?
- SaMD jest wyrobem medycznym i zawiera pewne wyrób medyczny do diagnostyki in vitro (IVD).
- Jest w stanie działać na platformach obliczeniowych ogólnego przeznaczenia (niemedycznych).
- Oprogramowanie nie spełnia definicji SaMD, jeśli jego przeznaczeniem jest sterowanie sprzętowymi urządzeniami medycznymi .
- Może być używany z innymi produktami, np. urządzeniami medycznymi.
- Może być połączony z innymi urządzeniami medycznymi, w tym sprzętowymi urządzeniami medycznymi i innym oprogramowaniem SaMD, a także oprogramowaniem ogólnego przeznaczenia.
Czynniki, które należy wziąć pod uwagę przy charakterystyce SaMD
SaMD można scharakteryzować na dwa sposoby:
Informacje dostarczone przez SaMD
- Aby diagnozować lub leczyć pacjentów
- Aby poinformować kierownictwo kliniczne
- Aby kierować leczeniem klinicznym
Stan opieki zdrowotnej
- Krytyczna kondycja
- Poważny stan
- Niepoważny stan
Na podstawie tych charakterystyk SaMD podzielono na cztery kategorie.
Jakie są przykłady oprogramowania jako urządzenia medycznego?
- Oprogramowanie jako urządzenie medyczne może być połączone z innymi gadżetami medycznymi, w tym sprzętowymi gadżetami medycznymi, oraz innym oprogramowaniem jako urządzeniem klinicznym, a także jako oprogramowanie ogólnego użytku. Oprogramowanie, które wyznacza granice, staje się wejściem dla innego sprzętu lub innego SaMD. Na przykład oprogramowaniem jako przykładem urządzenia medycznego może być oprogramowanie do planowania terapii, które dostarcza dane wykorzystywane w akceleratorze liniowym to SaMD.
- Na przykład oprogramowanie, które ma służyć do analizy stanu z wykorzystaniem trójosiowego akcelerometru, który działa na procesorze zainstalowanym w konsumenckim aparacie cyfrowym, jest postrzegane jako oprogramowanie jako urządzenie medyczne.
- Oprogramowanie, które jest połączone ze sprzętem medycznym, ale nie jest wymagane przez to urządzenie do realizacji jego celów medycznych, jest Oprogramowaniem jako Urządzeniem Medycznym, a nie akcesorium do urządzenia medycznego.
- Oprogramowanie SMD może działać na platformach obliczeniowych ogólnego przeznaczenia (tj. z powodów nieklinicznych). To oprogramowanie działające na platformach komputerowych ogólnego przeznaczenia może znajdować się w sprzętowym gadżecie medycznym.
Kategoria Mądre Przykłady SaMD
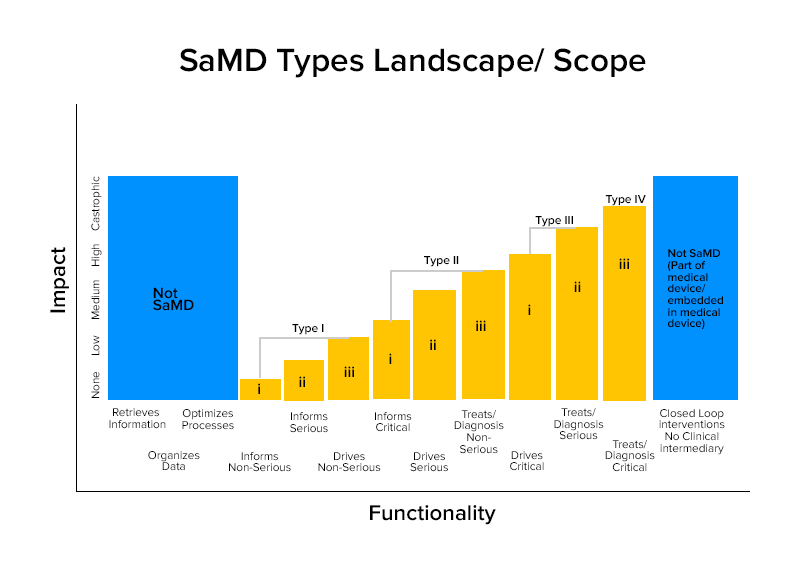
Kategoria IV:
- SaMDs, które przeprowadzają diagnostyczną analizę obrazu w celu umożliwienia podjęcia decyzji o leczeniu w przypadku ostrego udaru u pacjentów
- SaMD, które obliczają fraktalny wymiar zmiany i budują mapę strukturalną, która ujawnia różne wzorce wzrostu w celu zapewnienia diagnozy lub identyfikacji, czy zmiana jest łagodna czy złośliwa.
- SaMD łączą dane z testów immunologicznych , aby przeszukiwać pod kątem epidemii zmutowanych patogenów, które mogą być wysoce zakaźne.
Kategoria III:

- SaMD, który wykorzystuje mikrofon telefonu do wykrywania przerw w oddychaniu podczas snu.
- Służy do dostarczania informacji poprzez klikanie zdjęć, monitorowanie wzrostu lub inne dane w celu uzupełnienia innych informacji, które pracownik służby zdrowia wykorzystuje do diagnozowania, czy zmiana skórna jest łagodna lub złośliwa.
Kategoria II:
- SaMD, które analizują tętno.
- SaMD, które wykorzystują dane z kartoteki zdrowia poszczególnych osób do przewidywania ryzyka chorób serca lub udaru mózgu i tworzą strategie profilaktyczne.
- SaMD, które integrują i analizują wiele testów, oferując zalecenia dotyczące diagnozy w określonych wskazaniach klinicznych.
Kategoria I:
- Oprogramowanie medyczne Urządzenia gromadzące dane z dzienników objawów w celu dostarczenia informacji do oceny występowania epizodu astmy.
- Oprogramowanie medyczne Urządzenia analizujące obrazy, ruch oka do kierowania kolejnym działaniem diagnostycznym pod kątem astygmatyzmu.
- Oprogramowanie , które przechowuje historyczne informacje o ciśnieniu krwi do przeglądu przez pracowników służby zdrowia.
- Oprogramowanie wykorzystujące dane dotyczące wrażliwości słuchu, mowy w hałasie i proszące użytkowników o wypełnienie kwestionariuszy dotyczących typowych sytuacji słuchowych w celu samooceny ubytku słuchu.
Jak klasyfikujesz oprogramowanie jako wyrób medyczny?
Nowe rozporządzenie UE MDR (rozporządzenie Unii Europejskiej dotyczące urządzeń medycznych) zawiera definicje, zasady, klasyfikacje i wymogi proceduralne dotyczące standardów oprogramowania urządzeń medycznych.
Załącznik VIII do rozporządzenia UE MDR mówi o różnych programach jako zasadach klasyfikacji wyrobów medycznych.
Zasada 11 w załączniku VIII dotyczy klasyfikacji oprogramowania, aw szczególności dotyczy klasyfikacji oprogramowania używanego samodzielnie lub w połączeniu z wyrobami medycznymi.
Oprogramowanie, które ma dostarczać dane, które są wykorzystywane do dokonywania wyborów w zakresie diagnozy lub celów terapeutycznych, jest klasyfikowane jako Klasa IIa, z wyjątkiem sytuacji, gdy takie wybory mają skutek, który może spowodować śmierć lub nieodwracalne pogorszenie stanu zdrowia osoby. W takich przypadkach jest to klasa III lub poważne pogorszenie stanu zdrowia jednostki lub interwencja chirurgiczna, w którym to przypadku zalicza się do klasy IIb.
Oprogramowanie przeznaczone do monitorowania procesów fizjologicznych jest delegowane jako klasa IIa, z wyjątkiem przypadków, gdy proponuje się je do obserwacji podstawowych parametrów fizjologicznych, gdy charakter odmian tych parametrów jest taki, że może spowodować bezpośrednie zagrożenie dla pacjenta, w którym to przypadku jest nazwany Klasa IIb. Całe pozostałe oprogramowanie jest delegowane jako Klasa I.
Na przykład oprogramowanie używane do monitorowania tętna lub niektórych innych parametrów fizjologicznych podczas rutynowych kontroli jest delegowane do klasy IIa. Jeśli przypadkiem monitorowanie koncentruje się na bezwzględnie ważnych parametrach fizjologicznych, a parametry te mogą spowodować bezpośrednie zagrożenie dla pacjenta, klasyfikację podnosi się do klasy IIb.
Co mogą zrobić producenci SaMD, aby zapewnić przepisy?
Firmy SaMD powinny mieć dobry system zarządzania jakością włączony w proces rozwoju, aby zapewnić zgodność z wszelkimi przepisami. Wybrana platforma QMS powinna być zgodna z wymogami regulacyjnymi, takimi jak FDA 21 CFR Part 820 i ISO 13485:2016.
Każdy błąd w tym kierunku może prowadzić do poważnych konsekwencji, a zablokowanie Twojej aplikacji jest tylko punktem krytycznym. Zwracając uwagę na kluczowe znaczenie, zaleca się, aby współpracować z firmą zajmującą się opracowywaniem niestandardowego oprogramowania do opieki zdrowotnej, która współpracuje z lekarzami, którzy w pełni rozumieją te przepisy i zgodność.
Wniosek
Firmy opracowujące aplikacje dla służby zdrowia w USA , które obecnie opracowują oprogramowanie do użytku w połączeniu z urządzeniami medycznymi lub jako samodzielne urządzenie medyczne, powinny być świadome tych zmian i upewnić się, że wdrożyły środki, aby zapewnić zgodność ich oprogramowania z nowym reżimem.

Często zadawane pytania dotyczące SaMD
P. Jakie są przykłady oprogramowania, które nie jest SaMD ?
- Aplikacje, których sprzęt medyczny potrzebuje do pełnienia swojej roli.
- Aplikacje zależne od danych urządzenia medycznego.
- Aplikacje umożliwiające komunikację i usprawnienie przepływu pracy klinicznej, takie jak planowanie wizyt, rozmowy wideo lub głosowe itp.
Przykłady aplikacji nie ograniczają się do nich. Istnieje wiele innych typów aplikacji, które nie wchodzą w zakres definicji SaMD.
P. Co właściwie może zrobić oprogramowanie jako urządzenie medyczne?
Aplikacje SaMD to te, które działają jako samodzielna aplikacja zdrowotna, która daje użytkownikom wgląd w ich zdrowie fizyczne poprzez diagnozowanie, przetwarzanie zdjęć rentgenowskich lub obliczanie dawek insuliny.
P. Co to jest IEC 62304?
IEC 62304 to norma określająca wymagania dotyczące cyklu życia potrzebne do tworzenia oprogramowania jako urządzenia medycznego i oprogramowania w urządzeniach medycznych. W połączeniu z normą ISO 13485 oferuje ramy, które są ważne dla bezpiecznego projektowania i konserwacji oprogramowania urządzeń medycznych.
P. Opisz swój proces QMS w zakresie opracowywania oprogramowania urządzeń medycznych
Posiadamy własny wewnętrzny SZJ do pracy z klientami medycznymi i farmaceutycznymi, aby zapewnić własną jakość. Nie jesteśmy audytowani przez klientów, osoby trzecie ani organy regulacyjne.
Etap 1 : Rozpocznij projekt: Przeprowadź telekonferencję inauguracyjną z Klientem, aby:
Przejrzyj plan projektu i harmonogram
Sfinalizuj kluczowe źródła informacji
Zdefiniuj zespół projektowy
Etap 2 : Przegląd dokumentacji: Oceń i zbadaj wszystkie istotne dokumenty, w tym istniejące informacje o produkcie, dane/plany niekliniczne i dokumentację regulacyjną. Źródłami tych informacji są:
Dane niekliniczne, korespondencja regulacyjna, specyfikacje techniczne produktów, odniesienia do wyrobów predykcyjnych, proponowane oświadczenia dotyczące produktów oraz zamierzone/wskazania do stosowania itp.
Etap 3 : Określ ścieżkę regulacyjną Korzystając z informacji z powyższej sekcji, Opracuj ścieżkę regulacyjną FDA określającą, czy 510(k) czy de novo jest najbardziej odpowiednia (strategia regulacyjna PMA jest bardziej złożona i będzie wymagać wyższego budżetu). Celem będzie doradzanie Klientowi optymalnego podejścia do FDA.
