Um guia de bolso para conformidades de saúde
Publicados: 2020-06-26A saúde é um dos setores dominantes que está sendo bombardeado com tecnologias digitais em um esforço para modernizar sua paisagem e serviços de infraestrutura.
Tomando como referência os gastos institucionais, a saúde supera os gastos do governo dos EUA por um bom trecho em correspondência com outros setores. Em 2017, os EUA destinaram US $ 3,5 trilhões para a saúde. Como parcela do PIB do país, isso foi de 17,7% . A saúde, nos EUA, não é um território confinado a negócios herdados com muito capital para investir e expandir, mas aberto a todos para participação.
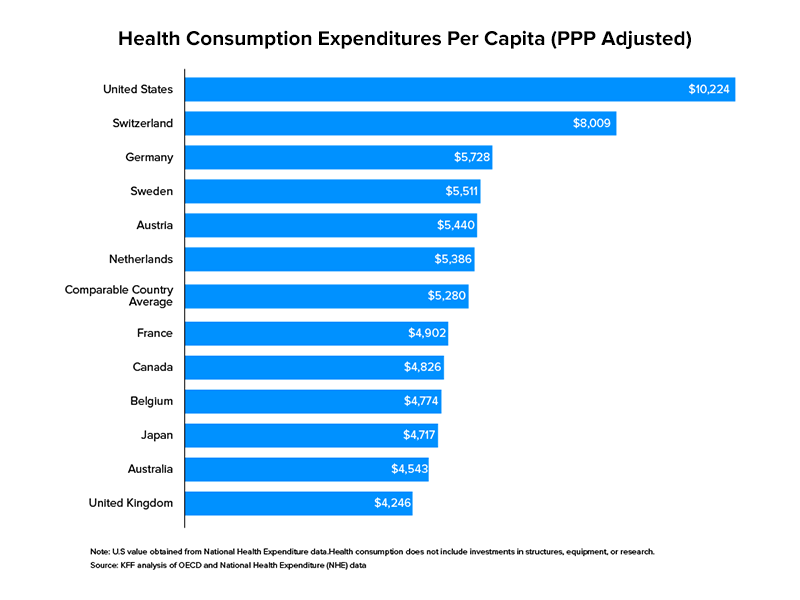
A saúde digital é uma perspectiva em desenvolvimento desse setor que abrange modelos de negócios como telessaúde, monitoramento remoto por meio de aplicativos de smartphone e entrega de medicamentos prescritos em domicílio. Somente em 2019, mais de US$ 17 bilhões foram arrecadados por startups que defendem a adoção da saúde digital em mais de 1.700 negócios nos Estados Unidos. Como esperado dessa mudança em andamento, o desenvolvimento da saúde móvel está no centro das atenções.
Desenvolver um produto que afirme impactar/melhorar a higiene pessoal é um osso duro de roer, não por causa dos desafios dos serviços de desenvolvimento de software de saúde envolvidos, mas por causa das diretrizes fiduciárias.
A Appinventiv está na vanguarda dessa mudança pulsando o coração da indústria graças aos nossos parceiros. Como uma empresa de desenvolvimento de aplicativos de saúde , estivemos lá e fizemos isso, o que era necessário para dar vida a ideias inovadoras . Como seu confidente, hoje discutiremos os regulamentos comuns e a conformidade que você deve ter em mente ao desenvolver um aplicativo de mHealth .
O que é conformidade com os regulamentos de saúde?
A conformidade regulatória na área da saúde diz respeito à adesão de uma associação médica às leis, diretrizes, regulamentos e especificações aplicáveis aos seus processos de negócios. A violação da conformidade regulatória traz regularmente punições legais, incluindo multas federais. É o ciclo contínuo de atendimento ou superação das normas legais, morais e profissionais pertinentes a uma determinada associação ou fornecedor de saúde.
Atualmente, as empresas de saúde, como hospitais e prestadores de serviços de saúde, têm membros de equipe dedicados que se concentram especialmente na conformidade regulatória. A razão e a vantagem essencial dos requisitos regulatórios para os hospitais são melhorar o atendimento ao paciente.
Qual é o objetivo da conformidade nos cuidados de saúde?
A conformidade com a saúde é um segmento fundamental de cada provedor médico. É a forma de seguir regras, diretrizes, leis e regulamentos que se relacionam com a prática dos serviços de saúde.
A conformidade na área da saúde abrange uma ampla variedade de práticas e observa regras internas e externas. No entanto, a maioria dos problemas de conformidade de serviços médicos se identifica com a segurança do paciente, a proteção dos dados do paciente e os ensaios de cobrança.
O Departamento de Saúde e Serviços Humanos dos EUA (HHS) criou padrões nacionais conhecidos como Lei de Portabilidade e Responsabilidade de Seguros de Saúde (HIPAA), e a característica central da conformidade médica é manter essa legislação.
Por que a conformidade com a saúde é importante?
A conformidade mantém as tarefas funcionando sem problemas e garante que todos sigam procedimentos legítimos e entendam as suposições.
No entanto, a conformidade em serviços médicos acompanha interesses significativamente maiores do que em diferentes setores. Por outro lado, se os médicos, como médicos e enfermeiros, não seguem procedimentos legítimos, podem acabar prejudicando um paciente ou outro membro da equipe.
Em última análise, a conformidade com a saúde é fornecer atendimento seguro e de alta qualidade ao paciente. A conformidade com os padrões e regulamentos do setor ajuda as organizações de saúde a continuarem a melhorar a qualidade do atendimento.
Por fim, a conformidade com os cuidados médicos é fornecer cuidados protegidos, de qualidade, seguros e ao paciente. A conformidade com as diretrizes e regulamentações do setor ajuda as organizações de saúde a continuar melhorando a qualidade do atendimento.
As organizações de saúde estão sujeitas a diretrizes, leis e regulamentos estritos do governo. As violações dessas leis podem resultar em ações judiciais, multas pesadas ou até mesmo perda de licenças.
O que é alto risco para problemas de conformidade?
Um marco regulatório serve como modelo utilizado para sancionar diretrizes. Tais estruturas podem ser criadas dentro de áreas de interesse explícitas, como o setor de saúde. Os governos frequentemente dependem da utilização de tais estruturas para criar e promulgar diretrizes, regras e leis. As estruturas regulatórias são geralmente desenvolvidas primeiro considerando o objetivo final em mente.
Vamos analisar a principal questão que está incomodando a todos: quais são os problemas de conformidade na área da saúde?
HIPAA e violações de dados
Acordos de compensação baseados em valor
Questões anti-propina e médico-hospitalar
Processos de Due Diligence
Qualificações do Provedor de Telessaúde
Contratados de Auditoria de Recuperação
Hospitais isentos de impostos e requisitos de conformidade
Regulamentos de saúde e conformidade nos EUA
A saúde digital tem restrições elaboradas, apontando os prós e contras da Tecnologia da Informação em Saúde (HIT), saúde móvel, prescrições personalizadas, tecnologia vestível e telessaúde. Os aplicativos móveis são uma das formas mais comuns de prestação de serviços de saúde , seja por meio de um serviço offline-online ou software como serviço. Se for esse o caso, os empreendedores devem fazer as seguintes perguntas e encontrar respostas objetivas para elas:

O questionário acima demarcaria se seu aplicativo móvel precisa de autorização fiduciária ou não. Desde que suas respostas tenham sido majoritariamente sim, existem três órgãos federais que analisarão a questão do seu produto de saúde móvel:
- Administração de Alimentos e Medicamentos (FDA)
- Comissão Federal de Comércio (FTC)
- Escritório de Direitos Civis (OCR)
Abaixo, damos uma olhada nas principais áreas federais de função e no escopo da verificação granular de fatos que uma empresa de desenvolvimento de software de saúde deve aconselhar seus clientes.
1. Lei de Portabilidade e Responsabilidade do Seguro Saúde (HIPAA)
Esta lei é aplicada pelo Office for Civil Rights (OCR) dentro do Departamento de Saúde e Serviços Humanos dos EUA. Esta regra de segurança HIPAA compatível com médicos protege as preocupações de privacidade e segurança de dados relacionados à saúde elegíveis e, em casos específicos, considera obrigatória a comunicação de violações de dados. O não cumprimento de uma regra de segurança específica da HIPAA pode resultar em penalidades a partir de um pagamento mínimo de US$ 100 e chegar a US$ 1,5 milhão em uma base de violação por incidente.
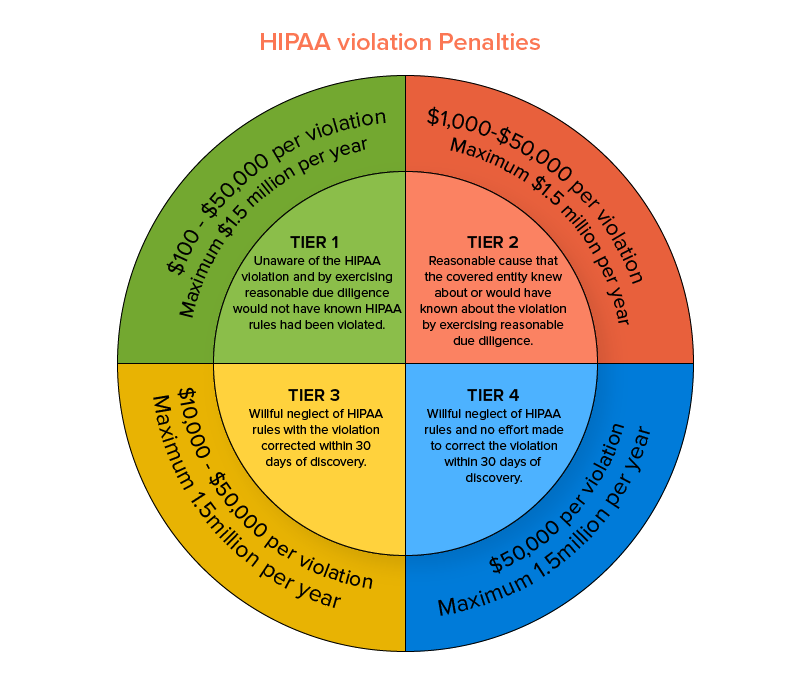
Agora que você tem uma ideia palpável da seriedade com que abordar o requisito dos regulamentos de saúde , devemos prosseguir e analisar os tipos de aplicativos médicos que devem cumprir as políticas tradicionais da HIPAA. Três 3 fatores regem os critérios de elegibilidade estabelecidos para que um aplicativo seja distinguido como médico em termos operacionais:
I. A natureza da entidade que usa o aplicativo.
Entidade refere-se ao cliente que usaria o aplicativo. Há um conjunto de médicos pré-definidos que são cobertos pela constituição da HIPAA, como médicos, médicos, organizações como hospitais e operadoras de planos de saúde. Se eles são os beneficiários diretos do aplicativo, a lista de regulamentos de saúde e conformidade regulatória hospitalar pela HIPAA terá que ser seguida palavra por palavra. Por outro lado, se o aplicativo simplesmente selecionar e compartilhar dicas de higiene ou conhecimento de bem-estar com o cliente, isso estará isento da constituição da HIPAA.
II. A natureza dos dados que o aplicativo produz, preserva e compartilha ainda mais.
Os dados são essenciais para as necessidades de funcionamento dos negócios online. As autoridades federais pressionam por leis que neguem preocupações de segurança, como violações de dados, e garantam a presença de uma infraestrutura de criptografia robusta. Em essência, os dados coletados não devem e não devem levar agentes mal-intencionados a pessoas por meio de suas informações pessoais, como endereço, número do seguro social etc. Se o aplicativo for lidar com o uso de tais pontos pessoais, as regras da HIPAA vai aplicar.

III. O software subjacente que alimenta o aplicativo.
O melhor desenvolvimento de aplicativos móveis de saúde deve se concentrar em inovar um aplicativo de telefone seguro. A HIPAA compartilha os detalhes das Informações de Saúde Protegidas (PHI) e orienta os fornecedores de software a criar uma rede de segurança em torno dela. Suas diretrizes possuem um profundo checklist de auditorias e controles internos a serem instalados para PHI.
2. Lei da Comissão Federal de Comércio (Lei FTC)
Este ato impõe protocolos regulatórios para lidar com reclamações injustas e más práticas nas empresas, também relacionadas a questões de privacidade e desafios gerais de segurança de dados. Reivindicações infundadas sobre o uso de um aplicativo são cobertas por esta lei. A regra de notificação de violação de saúde da FTC exige que empresas selecionadas relatem violações de dados, como registros pessoais de saúde.
3. Lei Federal de Alimentos, Medicamentos e Cosméticos (Lei FD&C)
A Food and Drug Administration é encarregada de implementar este ato. Seu principal objetivo é garantir que os dispositivos médicos, incluindo aplicativos móveis, qualifiquem as diretrizes padrão e, portanto, sejam seguros para serem consumidos em massa. É fundamental mencionarmos que nem todos os aplicativos de saúde se enquadram nessa jurisdição, mas alguns selecionados. Estes são os que, se não cumprirem as alegações, trazem sérias consequências à saúde do consumidor.
Regulamento Adicional Para a saúde digital
Enquanto os atos acima foram incisivamente direcionados a aplicações de saúde, existem outros que não foram instituídos pelo motivo, mas ajustados para incluir o mesmo. Nesta seção, avaliaremos uma visão geral dessas normas apoiadas pelo estado que os empreendedores de mHealth devem aderir.
1. Administração de Alimentos e Medicamentos (FDA)
A Food and Drug Administration é uma agência apoiada pelo governo dos EUA que constitui um componente-chave do Departamento de Saúde e Serviços Humanos dos EUA. Os desenvolvedores de aplicativos de saúde devem atender a esse conjunto de diretrizes bem definidas enquanto projetam aplicativos para obter uma liberação da FDA. Para o setor de saúde digital, o FDA categoriza os aplicativos móveis em lajes “médicas” com base nos dois postulados a seguir:

- O aplicativo é utilizado como acessório ao lado ou em conjunto com um dispositivo médico já regulamentado.
- O aplicativo transforma a plataforma móvel em um dispositivo móvel regulamentado
Com base na classificação de primeiro nível acima mencionada, o subsetor do aplicativo é definido com base em sua relação com as seguintes tecnologias digitais emergentes para se aproximar de uma aprovação do FDA.
I. Software como Dispositivo Médico (SaMD)
SaMD é definido como um modelo em que o software é empregado para fins médicos sem estar associado a um instrumento/dispositivo médico de hardware. O modelo é altamente flexível e pode ser aplicado a uma variedade de plataformas, desde redes virtuais até dispositivos médicos.
O International Medical Device Regulators Forum (IMDRF) é uma coalizão global que defende a governança sistemática de dispositivos médicos. Em 2013, formulou o Software as a Medical Device Working Group (SaMDWG) para introduzir orientações acionáveis para apoiar o avanço das tecnologias digitais neste segmento. Liderado pela própria FDA, o grupo documentou uma infinidade de estruturas sobre:
- Definições
- Classificação de risco
- Sistema de Gestão da Qualidade
- Avaliação clínica
Percorrer seus catálogos ajudará você a identificar se obterá uma aprovação SaMD ou não.
II. Dispositivos médicos sem fio
Refere-se a dispositivos médicos equipados com a capacidade de realizar uma transmissão sem fio de dados de barra de informações para facilitar os serviços de saúde. Esses kits de ferramentas implantam frequências de rádio para comunicação que podem ser transmitidas por Wi-Fi, Bluetooth ou um smartphone. Um exemplo comum, que você pode ter encontrado em escritórios corporativos, são os dispositivos de identificação por radiofrequência (RFID).

III. Telemedicina
A TI da Saúde é bifurcada em Telemedicina e Telessaúde para simplificar o processo de obtenção da aprovação da FDA. A telessaúde é designada como o uso de telecomunicações para promover e apoiar funções relacionadas à saúde – algo que ganhou ainda mais destaque desde o surto de COVID-19 . Uma empresa de desenvolvimento de software de saúde personalizado pode desenvolver aplicativos que usam:
- Videoconferência ao vivo (assíncrona)
- Videoconferência de armazenamento e encaminhamento (assíncrono)
- Monitoramento Remoto de Pacientes (RPM)
- Saúde móvel (mHealth)
4. TI de saúde
Nesse caso, é melhor citar a definição fornecida pelo Gabinete do Coordenador Nacional de Tecnologia da Informação em Saúde do Governo Federal, “hardware, software, tecnologias integradas ou licenças relacionadas, propriedade intelectual, atualizações ou soluções em pacote vendidas como serviços que são projetados para ou apoiam o uso por entidades de saúde ou pacientes para a criação, manutenção, acesso ou troca eletrônica de informações de saúde”.
V. Sistemas de Dados de Dispositivos Médicos (MDDS)
Produtos de hardware/software que podem ser usados para canalizar dados, preservar/armazenar informações, converter dados de um formato para outro ou simplesmente exibir dados científicos/médicos se enquadram na categoria MDDS. O objetivo de tais dispositivos não é contribuir com características adicionais ou aprimorar o conjunto de dados, mas simplesmente exibi-lo.
VI. Interoperabilidade de Dispositivos Médicos (MDI)
Sem dúvida, não há outro subdomínio de saúde digital em que o conceito de um aplicativo de telefone seguro seja um bom presságio do que o MDI. A Interoperabilidade de Dispositivos Médicos refere-se à troca multiplataforma/tecnológica de informações entre vários dispositivos. Ao contrário do MDDS, onde o motivo principal é a apresentação, os aplicativos MDI podem exibir, armazenar e analisar dados. Como resultado da comunicação de ida e volta, eles também podem ser usados para controlar outros produtos.
VII. Funções do software do dispositivo
Ao falar sobre essa categoria, a liberação é dada apenas aos aplicativos de software qualificados como “dispositivos” de acordo com as diretrizes da FDA. Dispositivos de software que têm risco mínimo ou nenhum para consumo podem não exigir uma aprovação oficial da FDA e a organização é explícita quando diz que, nesses casos,
“ exercerá discrição de aplicação e não esperará que os fabricantes enviem solicitações de revisão pré-mercado ou registrem e listem seus softwares na FDA. ”
VIII. Cíber segurança
A cibersegurança por si só não é um modo de classificação para um aplicativo mHealth. No entanto, a FDA quer estabelecer um Memorando de Entendimento (MOU) claro para que possa pesar os desafios de segurança de dados que o aplicativo apresenta em relação aos benefícios para os usuários.
IX. Inteligência Artificial/Aprendizado de Máquina
O impacto da IA na saúde é desproporcionalmente gigantesco em relação a outras tecnologias. No entanto, o avanço neste setor tem sido bastante recente, devido ao qual o FDA teve que fazer ajustes em seus marcos regulatórios. De acordo com suas diretrizes mais recentes, a FDA trabalhará lado a lado com os fabricantes para avaliar continuamente o software, começando nos estágios de desenvolvimento pré-mercado e culminando no estágio de desempenho pós-mercado. A estrutura se aplica especificamente ao SaMD.
2. Padrões HL7
A Health Level Seven International, simplesmente conhecida como HL7, é uma organização sem fins lucrativos constituída em 1983 que desenvolve referências da indústria para a troca, integração, compartilhamento e recuperação de informações eletrônicas de saúde que permitem a prática médica processual. Além disso, os padrões HL7 desempenham um papel rudimentar na gestão dos serviços de saúde, mantendo-se no curso para uma prestação de cuidados de saúde perfeita e avaliando os resultados.
Como eles fizeram isso?
Os padrões HL7 definem o empacotamento de informações para ser interoperável entre dois aplicativos de saúde, ditando o fluxo de trabalho para linguagem, formatos de dados e sua estrutura para integrar-se facilmente aos sistemas. Ao fazer isso, eles reduzem os investimentos em infraestrutura tecnológica e beneficiam os pacientes, tornando os cuidados de saúde mais acessíveis. O cumprimento das regras elaboradas para obter uma aprovação HL7 traz benefícios duplos para a regulamentação do setor de saúde . Primeiro, o aplicativo de saúde é universalmente aceito e está pronto para implantação em todo o mundo. E segundo, o custo do desenvolvimento de aplicativos é reduzido.
3. A Lei HITECH
A Lei de Tecnologia da Informação em Saúde para Saúde Econômica e Clínica foi introduzida durante o regime do presidente Barack Obama em 2009. O objetivo da Lei HITECH era promover a adoção empresarial da Tecnologia da Informação em Saúde por meio de Registros Eletrônicos de Saúde (EHRs). A administração também apertou as pontas soltas em torno da Lei HIPAA de 1996, após a qual se tornou obrigatório que as empresas de saúde informassem os clientes se e quando suas credenciais fossem comprometidas.
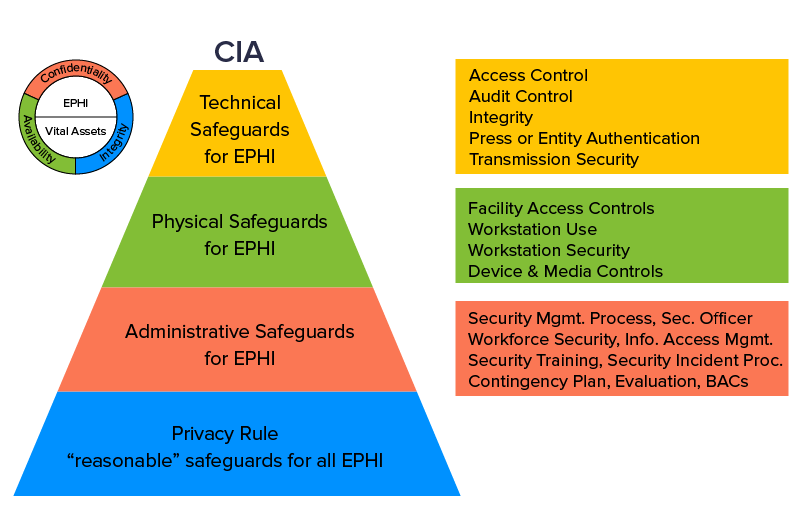
O efeito imediato do HITECH Act foi que o compartilhamento de informações entre duas entidades distintas tornou-se mais fácil de manusear graças aos EHRs. A lei também garantiu que a infraestrutura de segurança difícil de violar fosse instalada em coesão com os requisitos de privacidade e segurança da Lei HIPAA. Todos os requisitos regulatórios para obter uma aprovação HITECH foram incorporados à HIPAA por meio da Regra Final Omnibus, que resultou em ambos os atos sendo empilhados sob uma única legislação.
4. BYOD
O Bring Your Own Device (BYOD) é uma prática conceitual em que os empregadores da área de saúde permitem que a equipe médica use dispositivos pessoais, como, entre outros, smartphones e tablets para tarefas oficiais. As coisas podem piorar em um instante se sua solução mHealth não for personalizada para protocolos de segurança BYOD. Por exemplo, imagine um cenário em que um funcionário perde seu smartphone com o dispositivo tendo acesso a informações críticas de saúde protegidas (PHI).
É aqui que entra em jogo uma estratégia de Gerenciamento de Dispositivos Móveis fortemente pensada. Desde que os desenvolvedores do aplicativo tenham construído um recurso de apagamento remoto na solução mHealth, você pode apagar os dados associados ao dispositivo perdido. Funcionalidades semelhantes dentro do guarda-chuva BYOD incluem a proteção de aplicativos cliente, como e-mails e navegadores. Tomar nota dessas minúcias durante os estágios iniciais do SDLC pode ajudar as startups a obter uma aprovação BYOD eventualmente.
5. GDPR
O Regulamento Geral de Proteção de Dados foi criado pela União Europeia (UE) e se aplica a aplicativos de smartphone que coletam e processam dados de clientes de cidadãos da União Europeia. Com conversas de iterações semelhantes deste ato em obras além das fronteiras da UE, considera-se uma medida de segurança para os desenvolvedores de aplicativos criarem soluções de mHealth de acordo com o mesmo. A proteção da privacidade é a essência do GDPR por meio do qual as autoridades federais tentaram (com sucesso) entregar algum controle de dados pessoais ao leigo. Ele também mantém as práticas de negócios relacionadas ao gerenciamento de dados privados em aberto.

As disposições do GDPR exigem que os aplicativos móveis solicitem permissão, ou seja , consentimento ativo do usuário , antes de coletar ou processar seus dados. O aplicativo deve facilitar para o usuário compartilhar seu acordo por meio de uma caixa de seleção ou qualquer outro botão para clicar e registrar a ação. Além disso, essas caixas de seleção não devem ser pré-marcadas para afetar psicologicamente a escolha do usuário, que deve permanecer desimpedida. A página de Termos e Condições deve ter seu próprio botão “Concordo”. O GDPR democratizou amplamente o controle de dados pessoais, pois mesmo depois de dar seu consentimento, se os usuários optarem, eles podem revogar todos os direitos concedidos ao aplicativo e se desvincular. Ativar uma aprovação do GDPR das autoridades seria relativamente fácil, desde que a empresa de desenvolvimento de aplicativos para dispositivos móveis criasse uma solução em vista dessa discussão.
Pensamentos finais
Espera-se que os gastos nacionais com saúde atinjam US$ 5,7 trilhões até o ano de 2026, graças a tecnologias digitais como mHealth, telemedicina, sensores e tecnologia vestível e ferramentas de monitoramento remoto. Essas tendências de saúde são indicativas de uma marcha árdua de soluções médicas nunca antes vistas que incorporam tecnologia para um alcance instantâneo ao público. Espera-se também que tornem os cuidados de saúde acessíveis a todos como um direito básico a ter e não como um serviço a ser aproveitado. Enquanto você se concentra no lado comercial do empreendimento, deixe a Appinventiv - uma das principais agências de desenvolvimento de aplicativos de saúde nos EUA estar em modo de espera como seu guia tecnológico.
Estaríamos esperando para ouvir seus pensamentos.
