Программное обеспечение как медицинское устройство: определение и сфера действия правил
Опубликовано: 2019-09-06За последние 40 лет количество технологических инноваций как внутри медицинских устройств, так и вокруг них резко возросло. В частности, за последние 20 лет в этом секторе наблюдалось ускорение благодаря Интернету вещей и развитию других его соответствующих частей, таких как беспроводная связь, облачные вычисления, ИИ и т. д. Эти достижения изменили процессы здравоохранения.
Даже по прошествии 20 лет эти передовые технологии продолжают вызывать сейсмические сдвиги в процессе управления и оказания медицинской помощи.
И теперь мобильные приложения также проникли и стали важной частью этих востребованных, основанных на технологиях медицинских и немедицинских целей.
Эти приложения или программное обеспечение, которые сами по себе являются медицинскими устройствами – объем рынка программного обеспечения как медицинского устройства вырос и стал неотъемлемой частью жизни пользователей. Приложения программного обеспечения как медицинского изделия не ограничиваются только диагностикой, но также нашли свое место в процессе мониторинга и лечения. На самом деле именно программное обеспечение как медицинского изделия привело к эволюции здравоохранения 1.0 в здравоохранение 3.0 .
Видя растущее включение программного обеспечения как медицинского изделия в повседневное здравоохранение, международный форум регуляторов медицинского оборудования (IMDRF), членом которого является Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), подробно описал концепцию и категории риска программного обеспечения как медицинского изделия для индустрии разработки медицинских приложений. Программное обеспечение FDA как медицинское устройство разработало и уточнило политики, основанные на оценке риска, для лучшего информирования о требованиях и согласовало свой подход к регулированию с развивающимся характером цифровых устройств.
* SaMD — не единственное соответствие, которому должны следовать заинтересованные стороны отрасли здравоохранения — предприниматели приложений для мобильного здравоохранения и производители устройств. Существуют и другие соответствия, такие как FDA, HIPAA, HL7 и FCPA. Мы подробно рассмотрели эти требования в нашем В этой статье мы собираемся пролить свет на программное обеспечение как медицинское изделие, регулирование программного обеспечения как медицинского устройства, а также типы приложений mHealth и другие типы медицинского программного обеспечения , которые классифицируются как программное обеспечение как медицинское устройство.
Содержание
- Что такое программное обеспечение как медицинское устройство?
- Как узнать, является ли ваше мобильное приложение SaMD?
- Факторы, которые следует учитывать при характеристике программного обеспечения как медицинского изделия
- Каковы примеры программного обеспечения в качестве медицинского устройства?
- Как вы классифицируете программное обеспечение как медицинское устройство?
- Что могут сделать производители программного обеспечения как медицинского изделия для соблюдения правил?
- Вывод
- Часто задаваемые вопросы о SaMD
Что такое программное обеспечение как медицинское устройство?

Термин «Программное обеспечение как медицинское устройство» означает любое программное обеспечение, предназначенное для использования в одной или нескольких медицинских целях и выполняющее эти задачи без интеграции в аппаратное медицинское устройство.
Вот как IMDRAF определяет SaMD:
«Термин «Программное обеспечение как медицинское устройство» (SaMD) определяется как программное обеспечение, предназначенное для использования в одной или нескольких медицинских целях, которое выполняет эти цели, не являясь частью аппаратного медицинского устройства».
Как узнать, является ли ваше мобильное приложение SaMD?
- Программное обеспечение как медицинское изделие является медицинским устройством и включает некоторые медицинские устройства для диагностики in vitro (IVD).
- Он может работать на вычислительных платформах общего назначения (немедицинских).
- Программное обеспечение не соответствует определению программного обеспечения как медицинского изделия, если его предназначением является управление аппаратными медицинскими устройствами .
- Его можно использовать с другими продуктами, такими как медицинские устройства.
- Он может быть сопряжен с другими медицинскими устройствами, включая аппаратные медицинские устройства и другое программное обеспечение программного обеспечения как медицинского изделия, а также с программным обеспечением общего назначения.
Факторы, которые следует учитывать при характеристике программного обеспечения как медицинского изделия
Существует два способа характеристики программного обеспечения как медицинского изделия:
Информация предоставлена SaMD
- Для диагностики или лечения пациентов
- Для информирования клинического руководства
- Для управления клиническим ведением
Состояние здоровья
- Критическое состояние
- Серьезное состояние
- Нетяжелое состояние
На основе этих характеристик программное обеспечение как МД делится на четыре категории.
Каковы примеры программного обеспечения в качестве медицинского устройства?
- Программное обеспечение как медицинское устройство может быть сопряжено с другими медицинскими гаджетами, включая аппаратные медицинские гаджеты, и другим программным обеспечением в качестве клинического устройства, а также в качестве программного обеспечения общего пользования. Программное обеспечение, которое устанавливает границы, становится входными данными для другого аппаратного оборудования или другого программного обеспечения как медицинского изделия. Например, программное обеспечение в качестве примера медицинского устройства может представлять собой программное обеспечение для планирования терапии, которое предоставляет данные, используемые в линейном ускорителе, в виде программного обеспечения как медицинского изделия.
- Например, программное обеспечение, предназначенное для анализа состояния с использованием трехосевого акселерометра, работающего на процессоре, установленном на потребительской цифровой камере, рассматривается как программное обеспечение как медицинское устройство.
- Программное обеспечение, которое связано с медицинским аппаратным устройством, но не требуется этому устройству для выполнения его медицинских целей, является Программным обеспечением как Медицинским устройством, а не аксессуаром к медицинскому устройству.
- Программное обеспечение SMD может работать на вычислительных платформах общего назначения (т. е. неклинических). Это программное обеспечение, работающее на этих вычислительных платформах общего назначения, может находиться в аппаратном медицинском устройстве.
Примеры программного обеспечения как медицинского изделия с разбивкой по категориям
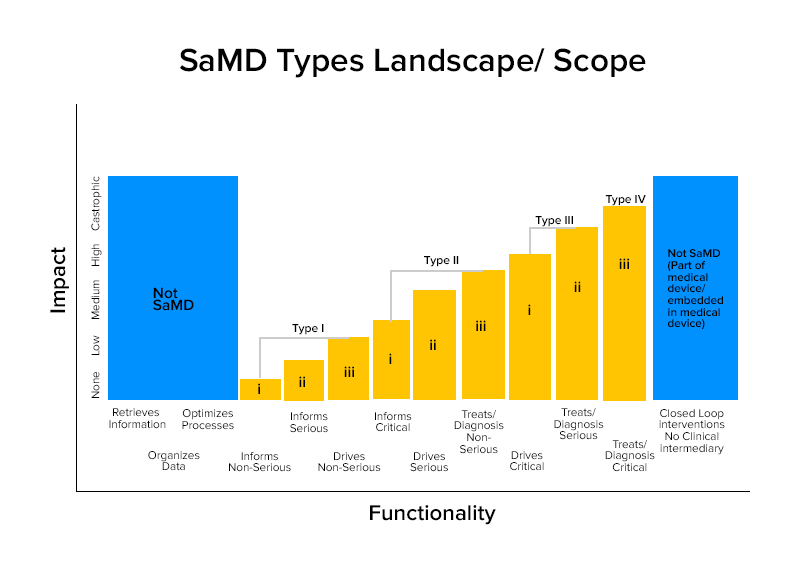
Категория IV:
- SaMD, которые выполняют диагностический анализ изображений для принятия решений о лечении, когда пациенты переносят острый инсульт.
- SaMD, которые рассчитывают фрактальную размерность поражения и строят структурную карту, которая показывает различные модели роста для обеспечения диагностики или идентификации, является ли поражение доброкачественным или злокачественным.
- SaMD объединяют данные иммунологических анализов для скрининга вспышек мутабельных патогенов, которые могут быть высококонтагиозными.
Категория III:

- SaMD, использующий микрофон телефона для обнаружения прерывистого дыхания во время сна.
- Он используется для предоставления информации путем нажатия на изображения, мониторинга роста или других данных в дополнение к другой информации, которую поставщик медицинских услуг использует для диагностики того, является ли поражение кожи доброкачественным или злокачественным.
Категория II:
- ПО SaMD, анализирующее частоту сердечных сокращений.
- SaMD, которые используют данные о состоянии здоровья людей для прогнозирования рисков сердечных заболеваний или инсульта и создают стратегии профилактики.
- Программное обеспечение как лекарственное средство, которое объединяет и анализирует несколько тестов, чтобы предложить рекомендации по диагностике при определенных клинических показаниях.
Категория I:
- Программное обеспечение Медицинские устройства , которые собирают данные из дневников симптомов для предоставления информации для оценки возникновения эпизода астмы.
- Программное обеспечение Медицинские устройства , анализирующие изображения, движение глаза для направления следующего диагностического действия при астигматизме.
- Программное обеспечение , в котором хранится историческая информация об артериальном давлении для медицинских работников.
- Программное обеспечение , использующее данные о чувствительности слуха, речи в шуме и предлагающее пользователям ответить на вопросники об общих слуховых ситуациях для самооценки потери слуха.
Как вы классифицируете программное обеспечение как медицинское устройство?
Новый EU MDR (Регламент Европейского союза по медицинским устройствам) содержит определения, правила, классификации и процедурные требования для стандартов программного обеспечения для медицинских устройств.
В Приложении VIII к MDR ЕС говорится о различном программном обеспечении как о правилах классификации медицинских устройств.
Правило 11 в Приложении VIII относится к классификации программного обеспечения и конкретно касается классификации программного обеспечения, используемого отдельно или в сочетании с медицинскими устройствами.
Программное обеспечение, предназначенное для предоставления данных, которые используются для выбора с точки зрения диагностики или терапевтических целей, классифицируется как класс IIa, за исключением случаев, когда такой выбор может привести к смерти или необратимому ухудшению здоровья человека. В таких случаях это относится к классу III или серьезному ухудшению состояния здоровья человека или хирургическому вмешательству, и в этом случае оно классифицируется как класс IIb.
Программное обеспечение, предназначенное для скрининга физиологических процессов, относится к классу IIa, за исключением случаев, когда оно предлагается для наблюдения за основными физиологическими параметрами, когда природа разновидностей этих параметров такова, что может создать непосредственную угрозу для пациента, и в этом случае оно назван классом IIb. Все остальное программное обеспечение относится к классу I.
Например, программное обеспечение, используемое для скрининга частоты сердечных сокращений или некоторых других физиологических параметров во время обычного осмотра, относится к классу IIa. Если по какой-либо причине мониторинг фокусируется на императивных физиологических параметрах, и если эти параметры могут привести к непосредственной опасности для пациента, классификация повышается до класса IIb.
Что могут сделать производители программного обеспечения как медицинского изделия для соблюдения правил?
Компании программного обеспечения как медицинского изделия должны иметь хорошую систему управления качеством, включенную в процесс разработки, чтобы обеспечить соответствие любым правилам. Выбранная платформа СМК должна соответствовать нормативным требованиям, таким как FDA 21 CFR Part 820 и ISO 13485:2016.
Любой неверный шаг в этом направлении может привести к серьезным последствиям, а блокировка вашего приложения будет лишь переломным моментом. Принимая во внимание важность, рекомендуется, чтобы вы сотрудничали с компанией по разработке специального программного обеспечения для здравоохранения , которая работает вместе с практикующими врачами, которые полностью понимают эти правила и их соответствие.
Вывод
Компании-разработчики медицинских приложений в США, которые в настоящее время разрабатывают программное обеспечение для использования в сочетании с медицинскими устройствами или в качестве отдельного медицинского устройства, должны знать об этих изменениях и принимать меры для обеспечения соответствия их программного обеспечения новому режиму.

Часто задаваемые вопросы о SaMD
В. Каковы примеры программного обеспечения, не являющегося ПОМД ?
- Приложения, необходимые аппаратным медицинским устройствам для выполнения своей роли.
- Приложения, которые зависят от данных медицинского устройства.
- Приложения, которые позволяют общаться и оптимизировать клинический рабочий процесс, например, для планирования посещений, видео- или голосовых вызовов и т. д.
Примеры приложений не ограничиваются этим. Существует ряд других типов приложений, которые не подпадают под определение программного обеспечения как медицинского изделия.
В. Что на самом деле может делать программное обеспечение как медицинское устройство?
Приложения SaMD — это те, которые действуют как автономные медицинские приложения, которые дают пользователям представление об их физическом здоровье путем постановки диагноза, выполнения рентгеновских снимков или расчета доз инсулина.
В. Что такое IEC 62304?
IEC 62304 — это стандарт, определяющий требования к жизненному циклу, необходимые для создания программного обеспечения в качестве медицинского устройства и программного обеспечения для медицинских устройств. При использовании вместе с ISO 13485 он предлагает основу, важную для безопасного проектирования и обслуживания программного обеспечения медицинского устройства.
В. Опишите ваш процесс СМК для разработки программного обеспечения для медицинских устройств.
У нас есть собственная внутренняя СМК для работы с медицинским оборудованием и фармацевтическими клиентами, чтобы обеспечить собственное качество. Нас не проверяют клиенты, третьи лица или регулирующие органы.
Этап 1 : Инициация проекта: Проведите начальную телеконференцию с Заказчиком, чтобы:
Ознакомьтесь с планом и графиком проекта
Завершение работы над ключевыми источниками информации
Определить команду проекта
Этап 2 : Обзор документации: Оцените и изучите все соответствующие документы, включая существующую информацию о продукте, неклинические данные/планы и нормативную документацию. Источниками этой информации являются:
Неклинические данные, соответствие нормативным требованиям, технические характеристики продукта, ссылки на стандартные устройства, заявленные характеристики предлагаемого продукта и его предназначение/показания к применению и т. д.
Этап 3 : Определение пути регулирования Используя информацию из раздела выше, разработайте путь регулирования FDA, определяющий, является ли наиболее подходящим 510(k) или de novo (стратегия регулирования PMA более сложна и потребует более высокого бюджета). Цель будет состоять в том, чтобы посоветовать Клиенту оптимальный подход к FDA.
