Tıbbi Cihaz Olarak Yazılım: Yönetmeliklerin Tanımı ve Kapsamı
Yayınlanan: 2019-09-06Son 40 yıldan bu yana, hem tıbbi cihazların içinde hem de çevresindeki teknolojik yeniliklerin sayısı çarpıcı biçimde arttı. Özellikle son 20 yılda, Nesnelerin İnterneti ve kablosuz bağlantı, bulut bilişim ve yapay zeka gibi diğer karşılık gelen bölümlerinin yükselişi sayesinde sektörde bir hızlanma yaşandı. Bu gelişmeler sağlık süreçlerini dönüştürdü.
20 yıl sonra bile, bu öncü teknolojiler, sağlık hizmeti yönetimi ve sunumu sürecinde sismik bir değişim yaratmaya devam ediyor.
Ve şimdi, mobil uygulamalar da bu çok talep edilen, teknoloji tabanlı tıbbi ve tıbbi olmayan amaçların içine sızmış ve önemli bir parçası haline gelmiştir.
Kendi başlarına bir tıbbi cihaz olan bu Uygulamalar veya Yazılımlar - Tıbbi Cihaz Olarak Yazılım pazar büyüklüğü , kullanıcıların yaşamının doğal bir parçası haline geldi. SaMD uygulamaları sadece tanı ile sınırlı kalmamış, takip ve tedavi sürecinde de yerini almıştır. Aslında sağlık hizmetleri 1.0'dan sağlık hizmetleri 3.0'a evrimine yol açan SaMD'dir .
SaMD'nin günlük sağlık hizmetlerine artan katılımını gören ABD FDA'nın üyesi olduğu uluslararası tıbbi cihaz düzenleyicileri forumu (IMDRF), tıbbi uygulama geliştirme endüstrisinin takip etmesi için konsepti ve SaMD risk kategorilerini ayrıntılı olarak tanımladı. Tıbbi bir cihaz olarak FDA yazılımı, daha iyi gereksinim iletişimi için risk tabanlı politikalar geliştirdi ve netleştirdi ve düzenleyici yaklaşımını dijital cihazların gelişen doğasıyla uyumlu hale getirdi.
* SaMD, sağlık sektörü paydaşlarının – mSağlık uygulamaları girişimcilerinin ve cihaz üreticilerinin izlemesi gereken tek uyumluluk değildir. FDA, HIPAA, HL7 ve FCPA gibi başka uyumluluklar da vardır. Bu uyumluluklara Bu yazıda, Tıbbi Cihaz Olarak Yazılım olarak sınıflandırılan SaMD, tıbbi cihaz yönetmeliği olarak yazılım ve mHealth uygulama türleri ve diğer tıbbi yazılım türlerine biraz ışık tutacağız .
İçerik tablosu
- Tıbbi Cihaz Olarak Yazılım Nedir?
- Mobil uygulamanızın SaMD olup olmadığını nasıl anlarsınız?
- SaMD Karakterizasyonu için Dikkate Alınması Gereken Faktörler
- Tıbbi Cihaz Olarak Yazılım Örnekleri Nelerdir?
- Yazılımları Tıbbi Cihaz Olarak Nasıl Sınıflandırırsınız?
- SaMD Üreticileri Düzenlemeleri Sağlamak İçin Ne Yapabilir?
- Çözüm
- SaMD Hakkında SSS
Tıbbi Cihaz Olarak Yazılım Nedir?

Terminoloji - Tıbbi Cihaz Olarak Yazılım, bir veya birden fazla tıbbi amaç için kullanılması amaçlanan ve bu amaçları bir tıbbi donanım donanımına entegre edilmeden gerçekleştiren herhangi bir yazılımı ifade eder.
IMDRAF, SaMD'yi şöyle tanımlıyor –
"Tıbbi Cihaz Olarak Yazılım" (SaMD) terimi, tıbbi bir donanımın parçası olmaksızın bu amaçları gerçekleştiren bir veya daha fazla tıbbi amaç için kullanılması amaçlanan yazılım olarak tanımlanır.'
Mobil Uygulamanızın SaMD Olup Olmadığı Nasıl Anlaşılır?
- SaMD tıbbi bir cihazdır ve bazı in vitro tanı (IVD) tıbbi cihazlarını içerir.
- Genel amaçlı (tıbbi olmayan) bilgi işlem platformlarında çalışabilir.
- Yazılım , amacı donanım tıbbi cihazlarını çalıştırmaksa, SaMD tanımını karşılamaz .
- Tıbbi cihazlar gibi diğer ürünlerle birlikte kullanılabilir .
- Donanım tıbbi cihazları ve diğer SaMD yazılımlarının yanı sıra genel amaçlı yazılımlar dahil olmak üzere diğer tıbbi cihazlarla arayüz oluşturulabilir.
SaMD Karakterizasyonu için Dikkate Alınması Gereken Faktörler
SaMD'lerin karakterize edilmesinin iki yolu vardır:
SaMD tarafından sağlanan bilgiler
- Hastaları teşhis etmek veya tedavi etmek için
- Klinik yönetimi bilgilendirmek
- Klinik yönetimi yönlendirmek için
Sağlık Durumu
- Kritik durum
- Ciddi durum
- Ciddi olmayan durum
Bu karakterizasyonlara dayanarak, SaMD'ler dört kategoriye ayrılır.
Tıbbi Cihaz Olarak Yazılım Örnekleri Nelerdir?
- Tıbbi Cihaz Olarak Yazılım, tıbbi donanım cihazları dahil olmak üzere diğer tıbbi cihazlarla ve klinik cihaz olarak diğer yazılımlarla ve ayrıca genel kullanım yazılımı olarak arayüzlenebilir. Sınırlar veren yazılım, farklı bir donanım ekipmanı veya diğer SaMD için girdi olur. Örneğin, bir tıbbi cihaz örneği olarak yazılım, SaMD olan bir lineer hızlandırıcıda kullanılan verileri sağlayan terapi planlama yazılımı olabilir.
- Örneğin, bir tüketici dijital kamerasında kurulu işlemci üzerinde çalışan üç eksenli ivmeölçer kullanan bir durumun analizi için beklenen yazılım, Tıbbi Cihaz Olarak Yazılım olarak görülüyor.
- Bir tıbbi donanım aygıtına bağlı olan ancak bu aygıtın tıbbi amacını gerçekleştirmesi gerekmeyen yazılım, Tıbbi Aygıt Olarak Yazılım'dır ve tıbbi aygıtın bir aksesuarı değildir.
- SMD yazılımı, genel amaçlı (yani klinik olmayan nedenler) bilgi işlem platformlarında çalışabilir. Bu genel amaçlı bilgi işlem platformlarında çalışan bu yazılımlar, tıbbi bir donanım aygıtına yerleştirilebilir.
Kategori Bilge SaMD Örnekleri
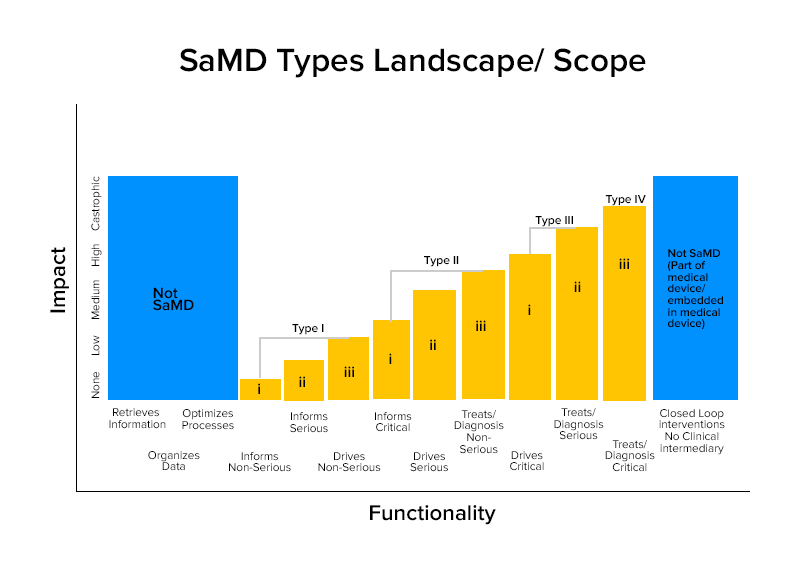
Kategori IV:
- Hastalar akut inme geçirdiğinde tedavi kararlarını etkinleştirmek için tanısal görüntü analizi yapan SaMD'ler
- Bir lezyonun fraktal boyutunu hesaplayan ve lezyonun iyi huylu veya kötü huylu olup olmadığını teşhis veya tanımlama sağlamak için farklı büyüme modellerini ortaya çıkaran yapısal bir harita oluşturan SaMD'ler .
- SaMD'ler , yüksek oranda bulaşıcı olabilen değişken patojen salgınlarını taramak için immünolojik testlerden gelen verileri birleştirir .
Kategori III:

- Uyku sırasında kesintiye uğrayan solunumu algılamak için telefonun mikrofonunu kullanan SaMD .
- Bir sağlık hizmeti sağlayıcısının bir cilt lezyonunun iyi huylu veya kötü huylu olup olmadığını teşhis etmek için kullandığı diğer bilgileri desteklemek için resimlere tıklayarak, büyümeyi veya diğer verileri izleyerek bilgi sağlamak için kullanılır .
Kategori II:
- Kalp atış hızını analiz eden SaMD'ler.
- Kalp hastalığı veya felç risklerini tahmin etmek için bireylerin sağlık kayıt verilerini kullanan ve önleme stratejileri oluşturan SaMD.
- Belirli klinik endikasyonlarda tanı için öneriler sunmak için birden fazla testi entegre eden ve analiz eden SaMD.
Kategori I:
- Bir astım epizodunun oluşumunu ölçmek için bilgi sağlamak için semptom günlüklerinden veri toplayan yazılım tıbbi Cihazları .
- Astigmatizma için bir sonraki teşhis eylemine rehberlik etmek için görüntüleri, gözün hareketini analiz eden yazılım tıbbi Cihazları .
- Sağlık hizmeti sağlayıcılarının gözden geçirmesi için geçmiş tansiyon bilgilerini depolayan yazılımlar .
- İşitme duyarlılığı, gürültüde konuşma verilerini kullanan ve kullanıcılardan kendi kendine işitme kaybı değerlendirmesi için yaygın dinleme durumları hakkında anketleri yanıtlamalarını isteyen yazılımlar .
Yazılımları Tıbbi Cihaz Olarak Nasıl Sınıflandırırsınız?
Yeni AB MDR (Avrupa Birliği Tıbbi Cihaz Yönetmeliği), tıbbi cihaz yazılım standartları için tanımlar, kurallar, sınıflandırmalar ve prosedürel gereklilikler sağlar.
AB MDR Ek VIII, tıbbi cihaz sınıflandırma kuralları olarak çeşitli yazılımlardan bahseder.
Ek VIII'deki Kural 11, yazılımın sınıflandırılmasıyla ilgilidir ve özellikle tek başına veya tıbbi cihazlarla birlikte kullanılan yazılımların sınıflandırılmasını ele alır.
Teşhis veya tedavi amaçlı seçimler yapmak için kullanılan verileri sağlamak üzere planlanan yazılımlar, bu tür seçimlerin kişinin ölümüne veya kişinin sağlığının geri döndürülemez şekilde bozulmasına neden olabilecek bir etkiye sahip olması dışında, Sınıf IIa olarak sınıflandırılır. Bu gibi durumlarda, Sınıf III'tedir veya bireyin sağlık durumunda ciddi bir bozulma veya cerrahi müdahale, bu durumda Sınıf IIb olarak sınıflandırılır.
Fizyolojik süreçleri taraması beklenen yazılım, temel fizyolojik parametreleri gözlemlemek için önerilmişse, bu parametrelerin çeşitlerinin doğasının hasta için acil tehdit oluşturabilecek şekilde olduğu durumlar dışında, Sınıf IIa olarak atanır. Sınıf IIb olarak adlandırılır. Kalan tüm diğer yazılımlar, Sınıf I olarak yetkilendirilir.
Örneğin, rutin bir kontrol sırasında kalp atış hızlarını veya diğer bazı fizyolojik parametreleri taramak için kullanılan yazılım, Sınıf IIa olarak atanır. Herhangi bir şans eseri izleme zorunlu fizyolojik parametrelere odaklanırsa ve bu parametrelerin hasta için acil bir tehlike oluşturabileceği durumlarda, sınıflandırma Sınıf IIb'ye yükseltilir.
SaMD Üreticileri Düzenlemeleri Sağlamak İçin Ne Yapabilir?
SaMD şirketleri, herhangi bir düzenlemeye uygunluğu sağlamak için geliştirme sürecine dahil edilmiş iyi bir Kalite Yönetim Sistemine sahip olmalıdır. Seçilen KYS platformu, FDA 21 CFR Bölüm 820 ve ISO 13485:2016 gibi düzenleyici gerekliliklerle uyumlu olmalıdır.
Yöndeki herhangi bir yanlış adım, başvurunuzun yalnızca devrilme noktası olarak yasaklanmasıyla ciddi sonuçlara yol açabilir. Önemi dikkate alındığında, bu düzenlemeleri ve uyumları bütünüyle anlayan tıp pratisyenleriyle birlikte çalışan özel bir sağlık yazılımı geliştirme şirketiyle ortak olmanız önerilir .
Çözüm
ABD'de şu anda tıbbi cihazlarla bağlantılı olarak veya bağımsız bir tıbbi cihaz olarak kullanılmak üzere yazılım geliştiren sağlık uygulaması geliştirme şirketleri, bu değişikliklerin farkında olmalı ve yazılımlarının yeni rejimle uyumlu olmasını sağlamak için önlemleri uyguladığından emin olmalıdır.

SaMD Hakkında SSS
S. SaMD olmayan yazılım örnekleri nelerdir ?
- Donanım tıbbi cihazlarının rolünü yerine getirmek için ihtiyaç duyduğu uygulamalar.
- Tıbbi cihaz verilerine bağımlı uygulamalar.
- Ziyaretleri planlamak, görüntülü veya sesli arama vb. için olanlar gibi klinik iş akışının iletişimini ve düzene sokulmasını sağlayan uygulamalar
Uygulama örnekleri bunlarla sınırlı değil. SaMD'lerin tanımına girmeyen bir dizi başka uygulama türü vardır.
S. Tıbbi Cihaz Olarak Yazılım aslında ne yapabilir?
SaMD uygulamaları, teşhis yaparak, X-ışını işlemi yaparak veya insülin dozlarını hesaplayarak kullanıcılara fiziksel sağlıkları hakkında fikir veren bağımsız bir sağlık uygulaması olarak hareket eden uygulamalardır.
S. IEC 62304 nedir?
IEC 62304, Tıbbi Cihaz Olarak Yazılım ve tıbbi cihazlar içinde Yazılım oluşturulması için gereken yaşam döngüsü gereksinimlerini belirten bir standarttır. ISO 13485 ile birlikte kullanıldığında, tıbbi cihaz yazılımının güvenli tasarımı ve bakımı için önemli olan bir çerçeve sunar.
Q. Tıbbi cihaz yazılımı geliştirme için KYS sürecinizi tanımlayın
Kendi kalitemizi sağlamak için tıbbi cihaz ve farmasötik müşterilerle çalışmak için kendi dahili QMS'miz var. Müşteriler, üçüncü taraflar veya düzenleyiciler tarafından denetlenmiyoruz.
1. Aşama : Projeyi Başlatın: Müşteri ile aşağıdakileri gerçekleştirmek için bir başlangıç telekonferansı gerçekleştirin:
Proje planını ve zaman çizelgesini gözden geçirin
Önemli bilgi kaynaklarını sonlandırın
Proje ekibini tanımlayın
Aşama 2 : Belgeleri Gözden Geçirin: Mevcut ürün bilgileri, klinik olmayan veriler/planlar ve düzenleyici belgeler dahil olmak üzere tüm ilgili belgeleri değerlendirin ve inceleyin. Bu bilgilerin kaynakları şunlardır:
Klinik olmayan veriler, düzenleyici yazışmalar, ürün teknik özellikleri, öncül cihazlara referanslar, önerilen ürün iddiaları ve kullanım amacı/endikasyonları vb.
Aşama 3 : Düzenleyici Yolu Belirleyin Yukarıdaki bölümdeki bilgileri kullanarak, 510(k) veya de novo'nun en uygun olduğunu belirleyen bir FDA düzenleyici yol geliştirin (bir PMA düzenleyici stratejisi daha karmaşıktır ve daha yüksek bir bütçe gerektirir). Amaç, Müşteriye FDA'ya en uygun yaklaşım konusunda tavsiyede bulunmak olacaktır.
