作为医疗器械的软件:法规的定义和范围
已发表: 2019-09-06自过去 40 年以来,医疗设备内部和周围的技术创新数量急剧增加。 尤其是在过去的 20 年里,由于物联网以及无线连接、云计算和人工智能等其他相应部分的兴起,该行业的发展加速了。这些进步改变了医疗保健流程。
即使在 20 年后,这些前沿技术仍在继续推动医疗保健管理和交付过程的巨大转变。
而现在,移动应用程序也已经渗透并成为这些高需求、基于技术的医疗和非医疗用途的重要组成部分。
这些应用程序或软件本身就是医疗设备——软件作为医疗设备的市场规模已经发展成为用户生活中固有的一部分。 SaMD 的应用不仅限于诊断,而且在监测和治疗过程中也占有一席之地。 事实上,正是 SaMD 导致了医疗保健 1.0 向医疗保健 3.0 的演变。
看到 SaMD 越来越多地纳入日常医疗保健,美国 FDA 是其成员的国际医疗器械监管机构论坛 (IMDRF)详细描述了概念和 SaMD 风险类别,供医疗应用程序开发行业遵循。 作为一种医疗设备的FDA软件已经制定并明确了基于风险的政策,以更好地沟通需求,并使其监管方法与数字设备不断发展的性质保持一致。
* SaMD 并不是医疗保健行业利益相关者——移动医疗应用企业家和设备制造商应该遵循的唯一合规性。 还有其他合规性,例如 FDA、HIPAA、HL7 和 FCPA。 我们在我们的在本文中,我们将介绍SaMD、软件作为医疗设备法规,以及 mHealth 应用程序类型和其他类型的医疗软件,它们被归类为软件作为医疗设备。
表中的内容
- 什么是作为医疗设备的软件?
- 如何知道您的移动应用程序是否为 SaMD?
- SaMD 表征要考虑的因素
- 软件作为医疗设备的例子有哪些?
- 您如何将软件归类为医疗设备?
- SaMD制造商可以做些什么来确保法规?
- 结论
- 关于 SaMD 的常见问题
什么是作为医疗设备的软件?

术语——作为医疗设备的软件代表任何旨在用于一种或多种医疗目的并且无需集成到硬件医疗设备即可执行这些目的的软件。
以下是 IMDRAF 对 SaMD 的定义——
““作为医疗设备的软件”(SaMD) 一词被定义为旨在用于一个或多个医疗目的的软件,这些目的不属于硬件医疗设备的一部分。
如何知道您的移动应用程序是否为 SaMD?
- SaMD 是一种医疗设备,包括一些体外诊断 (IVD) 医疗设备。
- 它能够在通用(非医疗)计算平台上运行。
- 如果软件的预期目的是驱动硬件医疗设备,则软件不符合 SaMD 的定义。
- 它可以与其他产品一起使用,例如医疗设备。
- 它可以与其他医疗设备接口,包括硬件医疗设备和其他 SaMD 软件,以及通用软件。
SaMD 表征要考虑的因素
SaMD 有两种表征方式:
SaMD提供的信息
- 诊断或治疗患者
- 告知临床管理
- 推动临床管理
医疗状况
- 危急情况
- 病情严重
- 非严重情况
基于这些特征,SaMDs 分为四类。
软件作为医疗设备的例子有哪些?
- 作为医疗设备的软件可以与其他医疗设备接口,包括硬件医疗设备,以及作为临床设备的其他软件,也可以作为通用软件。 提供边界的软件成为不同硬件设备或其他 SaMD 的输入。 例如,作为医疗设备示例的软件可以是提供用于直线加速器的数据的治疗计划软件,即 SaMD。
- 例如,使用在消费类数码相机上安装的处理器上工作的三轴加速度计来分析状况的软件被视为医疗设备软件。
- 与医疗硬件设备连接但该设备不需要它来实现其医疗目的的软件是作为医疗设备的软件,而不是医疗设备的附件。
- SMD 软件能够在通用(即非临床原因)计算平台上运行。 在这些通用计算平台上运行的这些软件可以位于硬件医疗设备中。
SaMD的类别明智的例子
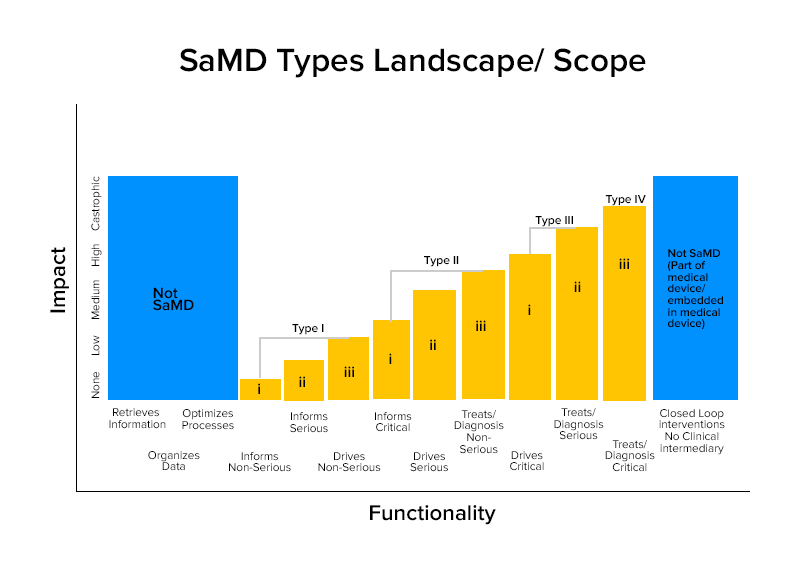
第四类:
- SaMD 执行诊断图像分析,以便在患者遭受急性中风时做出治疗决策
- SaMDs 计算病变的分形维数并构建结构图,揭示不同的生长模式,以提供病变是良性还是恶性的诊断或识别。
- SaMDs结合来自免疫测定的数据来筛选具有高度传染性的可变病原体爆发。
第三类:

- SaMD 利用手机的麦克风检测睡眠期间的呼吸中断。
- 它用于通过单击图片、监测生长或其他数据来提供信息,以补充医疗保健提供者用于诊断皮肤病变是良性还是恶性的其他信息。
第二类:
- 分析心率的 SaMD。
- SaMD 使用个人的健康记录数据来预测心脏病或中风的风险并制定预防策略。
- SaMD 整合和分析多项测试,为某些临床适应症的诊断提供建议。
第一类:
- 软件医疗设备,它从症状日记中收集数据,以提供信息来衡量哮喘发作的发生。
- 软件医疗设备分析图像、眼睛运动以指导散光的下一个诊断动作。
- 存储历史血压信息供医疗保健提供者查看的软件。
- 使用听力灵敏度、噪音中的语音数据,并要求用户回答有关常见听力情况的问卷以自我评估听力损失的软件。
您如何将软件归类为医疗设备?
新的欧盟 MDR(欧盟医疗器械法规)给出了医疗器械软件标准的定义、规则、分类和程序要求。
欧盟 MDR 附件 VIII 将各种软件作为医疗器械分类规则进行讨论。
附件 VIII 中的规则 11 涉及软件分类,特别涉及单独使用或与医疗器械结合使用的软件的分类。
计划提供用于在诊断或治疗目的方面做出选择的数据的软件被归类为 IIa 类,除非此类选择具有可能导致死亡或个人健康不可逆转恶化的影响。 在这种情况下,它属于 III 类或个人健康状况的严重恶化或外科手术,在这种情况下,它被归类为 IIb 类。
预期用于筛查生理过程的软件被授予 IIa 类,但如果建议用于观察基本生理参数的软件除外,其中这些参数的各种性质可能对患者带来直接威胁,在这种情况下,它是命名为 IIb 类。 所有其他剩余软件都被委派为 I 类。
例如,用于在例行检查期间筛查心率或其他一些生理参数的软件被指定为 IIa 类。 如果监测的重点是必要的生理参数,并且这些参数可能会给患者带来直接的危险,则分类将提高到 IIb 类。
SaMD制造商可以做些什么来确保法规?
SaMD 公司应将良好的质量管理体系纳入开发过程,以确保符合任何法规。 选择的 QMS 平台应该能够符合 FDA 21 CFR Part 820 和 ISO 13485:2016 等监管要求。
方向上的任何失误都可能导致严重后果,因为您的应用程序被禁止只是引爆点。 注意到重要性,建议您与定制医疗保健软件开发公司合作,该公司与完全了解这些法规和合规性的医生一起工作。
结论
美国的医疗应用程序开发公司目前正在开发与医疗设备结合使用或作为独立医疗设备使用的软件,应了解这些变化,并确保实施措施以确保其软件符合新制度。

关于 SaMD 的常见问题
Q. 不是SaMD的软件示例有哪些?
- 硬件医疗设备执行其角色所需的应用程序。
- 依赖于医疗设备数据的应用程序。
- 支持沟通和简化临床工作流程的应用程序,例如用于安排访问、视频或语音通话等的应用程序
应用程序示例不限于这些。 还有许多其他应用程序类型不属于 SaMD 的定义。
问:作为医疗设备的软件实际上可以做什么?
SaMD 应用程序是那些充当独立健康应用程序的应用程序,通过进行诊断、进行 X 射线处理或计算胰岛素剂量,让用户了解他们的身体健康状况。
问:什么是 IEC 62304?
IEC 62304 是一个标准,它指定了创建作为医疗设备的软件和医疗设备中的软件所需的生命周期要求。 当与 ISO 13485 一起使用时,它提供了一个对安全设计和维护医疗设备软件很重要的框架。
问:描述您的医疗器械软件开发质量管理体系流程
我们有自己的内部质量管理体系与医疗器械和制药客户合作,以确保我们自己的质量。 我们不会接受客户、第三方或监管机构的审计。
第 1 阶段:启动项目:与客户进行启动电话会议,以:
审查项目计划和时间表
确定关键信息来源
定义项目团队
第 2 阶段:审查文件:评估和检查所有相关文件,包括现有产品信息、非临床数据/计划和监管文件。 这些信息的来源是:
非临床数据、法规对应、产品技术规格、对谓词设备的引用、提议的产品声明和预期/使用适应症等。
第 3 阶段:确定监管途径 使用上述部分的信息,制定 FDA 监管途径,确定 510(k) 或从头是否最合适(PMA 监管策略更复杂,需要更高的预算)。 目标是向客户提供有关 FDA 最佳方法的建议。
