作為醫療器械的軟件:法規的定義和範圍
已發表: 2019-09-06自過去 40 年以來,醫療設備內部和周圍的技術創新數量急劇增加。 尤其是在過去的 20 年裡,由於物聯網以及無線連接、雲計算和人工智能等其他相應部分的興起,該行業的發展加速了。這些進步改變了醫療保健流程。
即使在 20 年後,這些前沿技術仍在繼續推動醫療保健管理和交付過程的巨大轉變。
而現在,移動應用程序也已經滲透並成為這些高需求、基於技術的醫療和非醫療用途的重要組成部分。
這些應用程序或軟件本身就是醫療設備——軟件作為醫療設備的市場規模已經發展成為用戶生活中固有的一部分。 SaMD 的應用不僅限於診斷,而且在監測和治療過程中也佔有一席之地。 事實上,正是 SaMD 導致了醫療保健 1.0 向醫療保健 3.0 的演變。
看到 SaMD 越來越多地納入日常醫療保健,美國 FDA 是其成員的國際醫療器械監管機構論壇 (IMDRF)詳細描述了概念和 SaMD 風險類別,供醫療應用程序開發行業遵循。 作為一種醫療設備的FDA軟件已經制定並明確了基於風險的政策,以更好地溝通需求,並使其監管方法與數字設備不斷發展的性質保持一致。
* SaMD 並不是醫療保健行業利益相關者——移動醫療應用企業家和設備製造商應該遵循的唯一合規性。 還有其他合規性,例如 FDA、HIPAA、HL7 和 FCPA。 我們在我們的在本文中,我們將介紹SaMD、軟件作為醫療設備法規,以及 mHealth 應用程序類型和其他類型的醫療軟件,它們被歸類為軟件作為醫療設備。
表中的內容
- 什麼是作為醫療設備的軟件?
- 如何知道您的移動應用程序是否為 SaMD?
- SaMD 表徵要考慮的因素
- 軟件作為醫療設備的例子有哪些?
- 您如何將軟件歸類為醫療設備?
- SaMD製造商可以做些什麼來確保法規?
- 結論
- 關於 SaMD 的常見問題
什麼是作為醫療設備的軟件?

術語——作為醫療設備的軟件代表任何旨在用於一種或多種醫療目的並且無需集成到硬件醫療設備即可執行這些目的的軟件。
以下是 IMDRAF 對 SaMD 的定義——
““作為醫療設備的軟件”(SaMD) 一詞被定義為旨在用於一個或多個醫療目的的軟件,這些目的不屬於硬件醫療設備的一部分。
如何知道您的移動應用程序是否為 SaMD?
- SaMD 是一種醫療設備,包括一些體外診斷 (IVD) 醫療設備。
- 它能夠在通用(非醫療)計算平台上運行。
- 如果軟件的預期目的是驅動硬件醫療設備,則軟件不符合 SaMD 的定義。
- 它可以與其他產品一起使用,例如醫療設備。
- 它可以與其他醫療設備接口,包括硬件醫療設備和其他 SaMD 軟件,以及通用軟件。
SaMD 表徵要考慮的因素
SaMD 有兩種表徵方式:
SaMD提供的信息
- 診斷或治療患者
- 告知臨床管理
- 推動臨床管理
醫療狀況
- 危急情況
- 病情嚴重
- 非嚴重情況
基於這些特徵,SaMDs 分為四類。
軟件作為醫療設備的例子有哪些?
- 作為醫療設備的軟件可以與其他醫療設備接口,包括硬件醫療設備,以及作為臨床設備的其他軟件,也可以作為通用軟件。 提供邊界的軟件成為不同硬件設備或其他 SaMD 的輸入。 例如,作為醫療設備示例的軟件可以是提供用於直線加速器的數據的治療計劃軟件,即 SaMD。
- 例如,使用在消費類數碼相機上安裝的處理器上工作的三軸加速度計來分析狀況的軟件被視為醫療設備軟件。
- 與醫療硬件設備連接但該設備不需要它來實現其醫療目的的軟件是作為醫療設備的軟件,而不是醫療設備的附件。
- SMD 軟件能夠在通用(即非臨床原因)計算平台上運行。 在這些通用計算平台上運行的這些軟件可以位於硬件醫療設備中。
SaMD的類別明智的例子
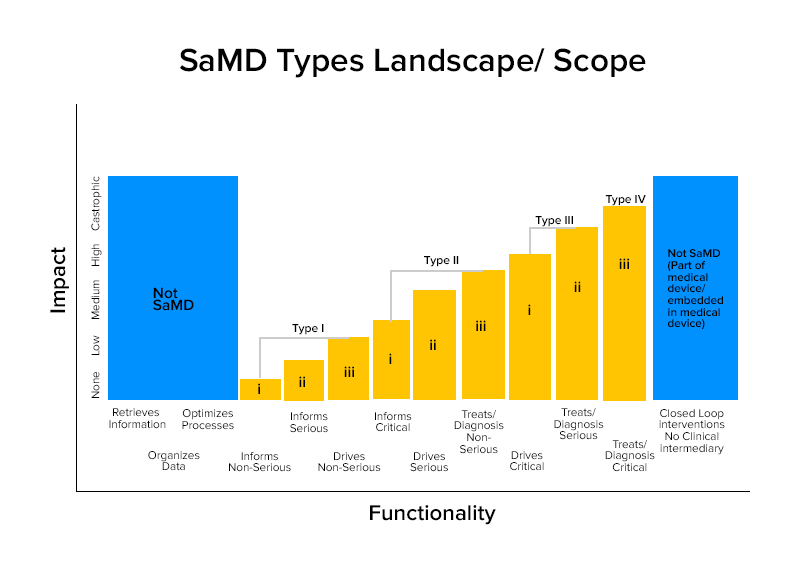
第四類:
- SaMD 執行診斷圖像分析,以便在患者遭受急性中風時做出治療決策
- SaMDs 計算病變的分形維數並構建結構圖,揭示不同的生長模式,以提供病變是良性還是惡性的診斷或識別。
- SaMDs結合來自免疫測定的數據來篩選具有高度傳染性的可變病原體爆發。
第三類:

- SaMD 利用手機的麥克風檢測睡眠期間的呼吸中斷。
- 它用於通過單擊圖片、監測生長或其他數據來提供信息,以補充醫療保健提供者用於診斷皮膚病變是良性還是惡性的其他信息。
第二類:
- 分析心率的 SaMD。
- SaMD 使用個人的健康記錄數據來預測心髒病或中風的風險並製定預防策略。
- SaMD 整合和分析多項測試,為某些臨床適應症的診斷提供建議。
第一類:
- 軟件醫療設備,它從症狀日記中收集數據,以提供信息來衡量哮喘發作的發生。
- 軟件醫療設備分析圖像、眼睛運動以指導散光的下一個診斷動作。
- 存儲歷史血壓信息供醫療保健提供者查看的軟件。
- 使用聽力靈敏度、噪音中的語音數據,並要求用戶回答有關常見聽力情況的問卷以自我評估聽力損失的軟件。
您如何將軟件歸類為醫療設備?
新的歐盟 MDR(歐盟醫療器械法規)給出了醫療器械軟件標準的定義、規則、分類和程序要求。
歐盟 MDR 附件 VIII 將各種軟件作為醫療器械分類規則進行討論。
附件 VIII 中的規則 11 涉及軟件分類,特別涉及單獨使用或與醫療器械結合使用的軟件的分類。
計劃提供用於在診斷或治療目的方面做出選擇的數據的軟件被歸類為 IIa 類,除非此類選擇具有可能導致死亡或個人健康不可逆轉惡化的影響。 在這種情況下,它屬於 III 類或個人健康狀況的嚴重惡化或外科手術,在這種情況下,它被歸類為 IIb 類。
預期用於篩查生理過程的軟件被授予 IIa 類,但如果建議用於觀察基本生理參數的軟件除外,其中這些參數的各種性質可能對患者帶來直接威脅,在這種情況下,它是命名為 IIb 類。 所有其他剩餘軟件都被委派為 I 類。
例如,用於在例行檢查期間篩查心率或其他一些生理參數的軟件被指定為 IIa 類。 如果監測的重點是必要的生理參數,並且這些參數可能會給患者帶來直接的危險,則分類將提高到 IIb 類。
SaMD製造商可以做些什麼來確保法規?
SaMD 公司應將良好的質量管理體系納入開發過程,以確保符合任何法規。 選擇的 QMS 平台應該能夠符合 FDA 21 CFR Part 820 和 ISO 13485:2016 等監管要求。
方向上的任何失誤都可能導致嚴重後果,因為您的應用程序被禁止只是引爆點。 注意到重要性,建議您與定制醫療保健軟件開發公司合作,該公司與完全了解這些法規和合規性的醫生一起工作。
結論
美國的醫療應用程序開發公司目前正在開發與醫療設備結合使用或作為獨立醫療設備使用的軟件,應了解這些變化,並確保實施措施以確保其軟件符合新制度。

關於 SaMD 的常見問題
Q. 不是SaMD的軟件示例有哪些?
- 硬件醫療設備執行其角色所需的應用程序。
- 依賴於醫療設備數據的應用程序。
- 支持溝通和簡化臨床工作流程的應用程序,例如用於安排訪問、視頻或語音通話等的應用程序
應用程序示例不限於這些。 還有許多其他應用程序類型不屬於 SaMD 的定義。
問:作為醫療設備的軟件實際上可以做什麼?
SaMD 應用程序是那些充當獨立健康應用程序的應用程序,通過進行診斷、進行 X 射線處理或計算胰島素劑量,讓用戶了解他們的身體健康狀況。
問:什麼是 IEC 62304?
IEC 62304 是一個標準,它指定了創建作為醫療設備的軟件和醫療設備中的軟件所需的生命週期要求。 當與 ISO 13485 一起使用時,它提供了一個對安全設計和維護醫療設備軟件很重要的框架。
問:描述您的醫療器械軟件開髮質量管理體系流程
我們有自己的內部質量管理體係與醫療器械和製藥客戶合作,以確保我們自己的質量。 我們不會接受客戶、第三方或監管機構的審計。
第 1 階段:啟動項目:與客戶進行啟動電話會議,以:
審查項目計劃和時間表
確定關鍵信息來源
定義項目團隊
第 2 階段:審查文件:評估和檢查所有相關文件,包括現有產品信息、非臨床數據/計劃和監管文件。 這些信息的來源是:
非臨床數據、法規對應、產品技術規格、對謂詞設備的引用、提議的產品聲明和預期/使用適應症等。
第 3 階段:確定監管途徑 使用上述部分的信息,制定 FDA 監管途徑,確定 510(k) 或從頭是否最合適(PMA 監管策略更複雜,需要更高的預算)。 目標是向客戶提供有關 FDA 最佳方法的建議。
